Содержание
- 2. Ответы к самостоятельной работе: вариант 1 : 1) 3 2) 3 3) 2 4) 4 5)
- 3. Лабораторный опыт
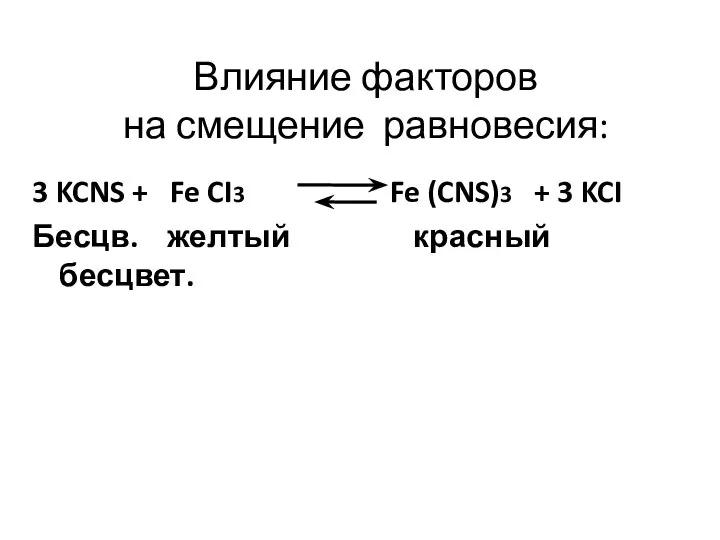
- 4. Влияние факторов на смещение равновесия: 3 KCNS + Fe CI3 Fe (CNS)3 + 3 KCI Бесцв.
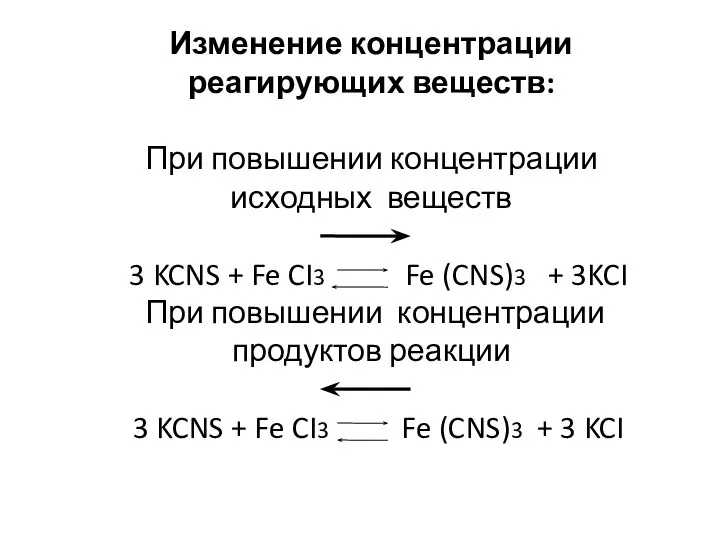
- 5. Изменение концентрации реагирующих веществ: При повышении концентрации исходных веществ 3 KCNS + Fe CI3 Fe (CNS)3
- 6. ↑Св-ва равновесие смещается в сторону реакции, в которой это вещество расходуется реакции, в которой это вещество
- 7. Изменение температуры: При повышении температуры : 3 KCNS + Fe CI3 Fe (CNS)3 + 3KCI При
- 8. Влияние температуры на равновесие: 2 NO2 N2 O4 Бурый бесцветный ПРИ ОХЛАЖДЕНИИ: 2 NO2 N2 O4
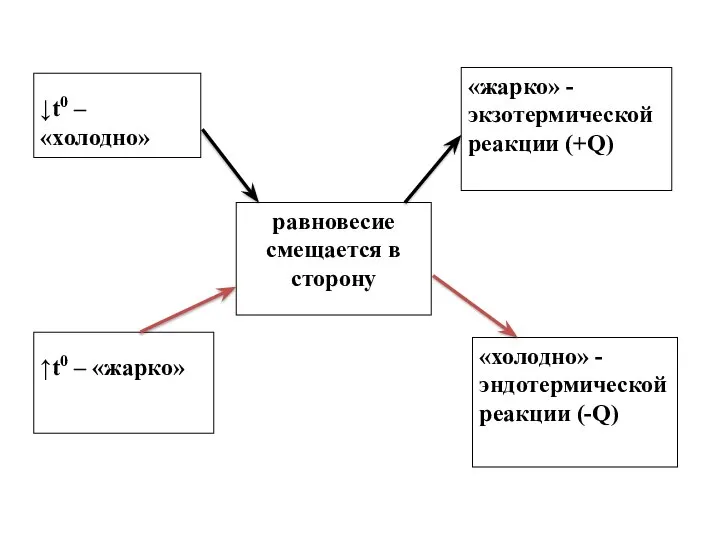
- 9. ↓t0 – «холодно» равновесие смещается в сторону «жарко» - экзотермической реакции (+Q) ↑t0 – «жарко» «холодно»
- 13. Влияние давления на смещение равновесия: 2 NO2 N2 O4 Бурый бесцветный При увеличении давления 2 NO2
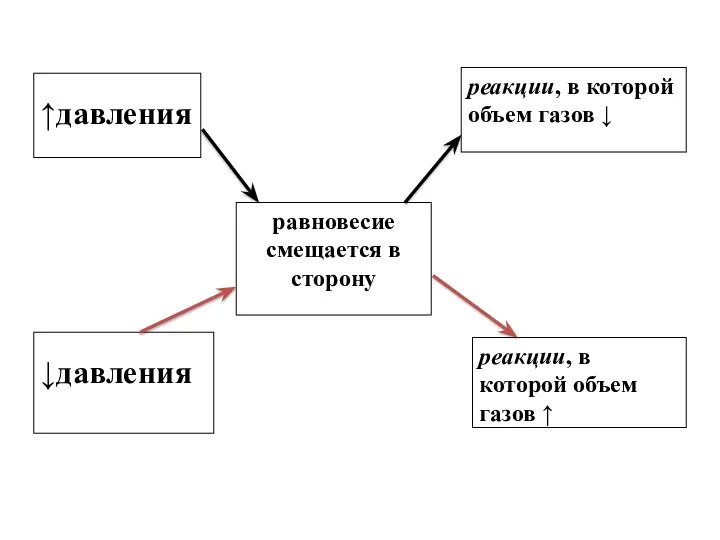
- 14. ↑давления равновесие смещается в сторону реакции, в которой объем газов ↓ ↓давления реакции, в которой объем
- 15. Jle Шателье Анри Луи (1850-1936) - французский физикохимик. Ле Шателье Анри Луи
- 16. Принцип Ле Шателье Если на систему, находящуюся в равновесии, оказать внешнее воздействие (изменить концентрацию, давление, температуру),
- 17. Получение аммиака в промышленности N2 + 3H2 2NH3
- 18. КАТАЛИЗАТОР НЕ ВЛИЯЕТ НА РАВНОВЕСИЕ В СИСТЕМЕ, ОН ИЗМЕНЯЕТ СКОРОСТЬ И ПРЯМОЙ И ОБРАТНОЙ РЕАКЦИИ. КАТАЛИЗАТОР
- 19. 1. При увеличении температуры химическое равновесие смещается в сторону… 2. При понижении температуры химическое равновесие смещается
- 20. Умение смещать равновесие очень важно для химических процессов. Но иногда оказывается не менее важным умение сохранять
- 21. 1. § 25 упражнение 4,5 2. Описать, какие условия необходимо учитывать при синтезе серной кислоты, этилового
- 22. ЧТОБЫ НЕЧТО ОСЛАБИТЬ, НЕОБХОДИМО ПРЕЖДЕ УСИЛИТЬ ЕГО. ЧТОБЫ НЕЧТО ОТНЯТЬ, НЕОБХОДИМО ПРЕЖДЕ ДАТЬ ЕГО. КИТАЙСКИЙ ФИЛОСОФ
- 25. Скачать презентацию


















 Общие понятия и определения опасных химических веществ. Модуль 1.1
Общие понятия и определения опасных химических веществ. Модуль 1.1 Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Природный газ Презентацию подготовили ученики 11-А класса Алчевской ИТГ Мозолевская Анастасия, Ткаченко Анастасия, Тульнов
Природный газ Презентацию подготовили ученики 11-А класса Алчевской ИТГ Мозолевская Анастасия, Ткаченко Анастасия, Тульнов  Растворы электролитов
Растворы электролитов Физико-математические основы химии: Количество вещества, Молярная масса, Молярный объём, Число Авогадро
Физико-математические основы химии: Количество вещества, Молярная масса, Молярный объём, Число Авогадро Генезис различных типов промежуточных фаз. Теория плотнейших упаковок
Генезис различных типов промежуточных фаз. Теория плотнейших упаковок Алмаз. Внутренняя структура алмаза
Алмаз. Внутренняя структура алмаза Жесткость воды
Жесткость воды Углекислый газ
Углекислый газ Трифенилметановые красители
Трифенилметановые красители Муниципальное образовательное учреждение «Лицей №3» Научно-исследовательская работа по химии «Получение ароматических масел»
Муниципальное образовательное учреждение «Лицей №3» Научно-исследовательская работа по химии «Получение ароматических масел» Электролитическая диссоциация
Электролитическая диссоциация Мысты электролитті тазалау
Мысты электролитті тазалау Классификация неорганических веществ
Классификация неорганических веществ Химические уравнения
Химические уравнения Презентация по Химии "Золото" - скачать смотреть бесплатно
Презентация по Химии "Золото" - скачать смотреть бесплатно Строение молекул некоторых широко распространенных гербицидов
Строение молекул некоторых широко распространенных гербицидов Функции белков «Жизнь – это способ существования белковых тел». Ф.Энгельс
Функции белков «Жизнь – это способ существования белковых тел». Ф.Энгельс Классификация и номенклатура органических соединений. (Лекция 1)
Классификация и номенклатура органических соединений. (Лекция 1) Поняття про лікарські препарати Підготували Стебко Марія, Бондар Аліна 11-Ф
Поняття про лікарські препарати Підготували Стебко Марія, Бондар Аліна 11-Ф  Загрязнение пищевых продуктов пестицидами
Загрязнение пищевых продуктов пестицидами Лавсан (полиэтилентерефталат)
Лавсан (полиэтилентерефталат) Предмет и задачи химии
Предмет и задачи химии Electron configuration and periodicity
Electron configuration and periodicity Всасывание продуктов гидролиза липидов в тонком кишечнике. Ресинтез жиров. Образование смешанных мицелл
Всасывание продуктов гидролиза липидов в тонком кишечнике. Ресинтез жиров. Образование смешанных мицелл Продолжение лекции «Химическая связь»
Продолжение лекции «Химическая связь» Химия в решении сырьевой проблемы
Химия в решении сырьевой проблемы Тағамдық және биологиялық белсенді қоспалар туралы жалпы мағлұматтар
Тағамдық және биологиялық белсенді қоспалар туралы жалпы мағлұматтар