Содержание
- 2. Электролиты Сильные Слабые Электролиты Истинные Потенциальные Ионные кристаллы: NaCl, NH4NO3 Молекулы, дающие ионы в результате взаимодействия
- 3. Растворение ионного кристалла в воде Почему электролиты диссоциируют в растворе ? Степень диссоциации (%) 0.5 мМ
- 4. Вывод законов Фарадея из представлений о ионах Масса выделившегося вещества ? – массе одной частицы, умноженной
- 5. Гидратация и сольватация ионов в растворах электролитов Растворение электролитов, как правило, экзотермический процесс, тогда как получение
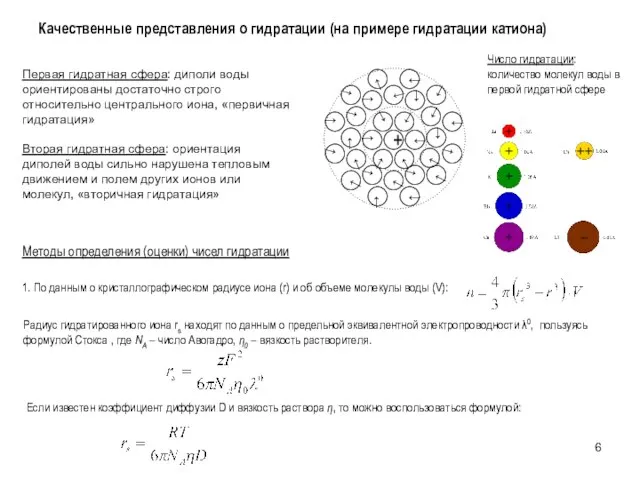
- 6. Качественные представления о гидратации (на примере гидратации катиона) Первая гидратная сфера: диполи воды ориентированы достаточно строго
- 7. Гидрофобная гидратация: замораживание льдоподобной структуры воды вблизи крупного иона или молекулы за счет экранирования «атак» других
- 8. Строго разделить ΔG и ΔH сольватации электролита на ионные составляющие невозможно. Предполагают, что эти величины одинаковы
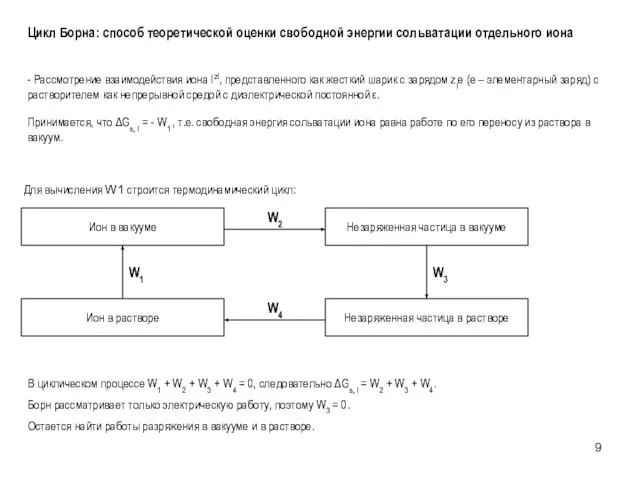
- 9. Цикл Борна: способ теоретической оценки свободной энергии сольватации отдельного иона - Рассмотрение взаимодействия иона IzI, представленного
- 10. Цикл Борна- продолжение Работа разряжения 1 моля ионов в среде растворителя - аналогично: Пользуясь уравнением Гиббса-Гельмгольца,
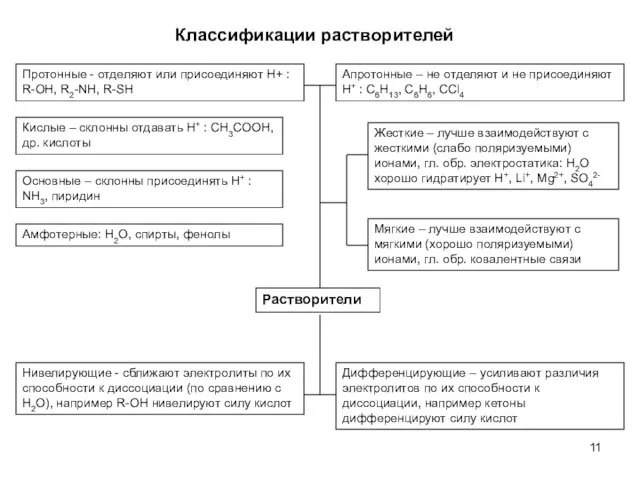
- 11. Классификации растворителей Растворители Кислые – склонны отдавать H+ : CH3COOH, др. кислоты Основные – склонны присоединять
- 12. Ионизирующая способность растворителей Степень диссоциации (%) 0.5 мМ растворов солей в различных растворителях Растворитель ε (C2H5)2NH2Pi
- 13. Активность и концентрация компонента Концентрация – величина, пропорциональная количеству вещества в единице массы или объема, в
- 14. Особенности термодинамики ионных систем Полные потенциалы – потенциалы, которые включают все виды работы, совершаемой при перемещении
- 15. Активность электролита, средние и ионные активности Следовательно, т.е. или Стандартное состояние:
- 16. Методы экспериментального определения коэффициентов активности 1.3. Криоскопический и эбуллиоскопический методы: по изменению температуры замерзания или кипения
- 17. 2.1. Экстракционный метод: μi(1) = μi(2) – приводят в равновесие растворы в двух несмешивающихся растворителях. Находят
- 18. Теория сильных электролитов Сильный электролит: вещество, которое полностью диссоциирует при любой его концентрации в растворе Экспериментальные
- 19. Задача: найти способ теоретического расчета электролитных (и ионных !) коэффициентов активности 1. Неидеальность вызвана межчастичными взаимодействиями:
- 20. Ищем выражение для “поправочного” слагаемого свободной энергии – ΔGcorr, рассматривая только кулоновское взаимодействие Стандартное состояние –
- 21. Работа разряжения иона сорта i в предельно разбавленном растворе Разряжение – изменение заряда иона от его
- 22. Работа заряжения иона сорта i в растворе конечной концентрации C Речь идет об аналогичном процессе, направленном
- 23. Связь потенциала объемного заряда с плотностью этого заряда (т.е. с распределением точечных зарядов в объеме) Уравнение
- 24. Общее решение имеет вид: α и β – константы интегрирования. Ищем их из граничных условий
- 25. Ионную атмосферу можно заменить зарядом, равным по величине заряду центрального иона, противоположным ему по знаку и
- 27. Более точные выражения теории Дебая-Хюккеля Поправка Хюккеля: учет объема самих ионов Интегрирование по всему объему раствора
- 28. Насколько адекватно теория Дебая-Хюккеля описывает реальность?
- 29. Более современные теории
- 30. Перенос электрического заряда в растворах электролитов Способы (виды) переноса: конвекция, диффузия, (электро)миграция Удельная электропроводность Вещество κ
- 31. Основное понятие, применяемое при описании процессов переноса вещества, теплоты, электрического заряда, и т.д. – плотность потока.
- 32. Речь идет о движении только вдоль оси x, символ вектора в дальнейшем не применяем + +
- 33. Подвижность иона Пусть система однородна (нет градиентов) даже по оси x. Тогда никакого направленного переноса не
- 34. Закон Ома для раствора электролита: Удельная электропроводность и удельное сопротивление не зависят от системы отсчета !
- 35. Причины зависимости молярной электропроводности от концентрации Электрофоретический (катафоретический) эффект При наложении внешнего поля ионы движутся в
- 36. + Причины зависимости молярной электропроводности от концентрации Релаксационный эффект При наложении внешнего поля центральный ион и
- 37. Теория электропроводности Онзагера Теория Онзагера учитывает межионные электростатические взаимодействия примерно также, как они учтены в теории
- 38. Эффекты Вина: увеличение электропроводности в сильных электрических полях 1-й эффект Вина В электрическом поле умеренной напряженности
- 39. Эффект Дебая-Фалькенгагена: увеличение электропроводности в переменном электрическом поле + Исходя из идеи ионной атмосферы, Дебай и
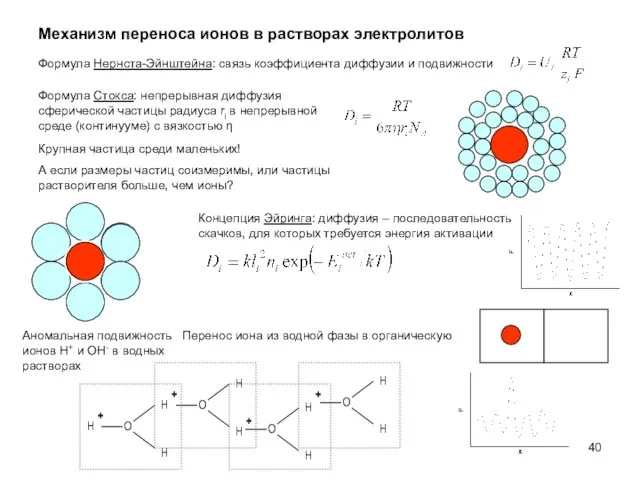
- 40. Механизм переноса ионов в растворах электролитов Аномальная подвижность ионов H+ и OH- в водных растворах Крупная
- 41. Кислотность водных и неводных растворов Шкала pH для водных растворов Ag│AgCl, буфер, KCl (m) │H2, Pt
- 42. Функции кислотности Аррениус: кислота (HA) – вещество, которое в водном растворе отщепляет ион водорода основание (BOH)
- 43. Расплавы солей В расплавах в значительной мере сохраняется квазикристаллический порядок чередования ионов различных знаков – как
- 45. Скачать презентацию






































 Презентация по Химии "Презентация Подгруппа азота" - скачать смотреть
Презентация по Химии "Презентация Подгруппа азота" - скачать смотреть  Лекарственное растительное сырье, содержащее жиры
Лекарственное растительное сырье, содержащее жиры Пластмаси, синтетичні каучуки, гума, штучні й синтетичні
Пластмаси, синтетичні каучуки, гума, штучні й синтетичні Презентация по Химии "Тема: Цікаві факти з життя Д.І. Менделєєва" - скачать смотреть бесплатно
Презентация по Химии "Тема: Цікаві факти з життя Д.І. Менделєєва" - скачать смотреть бесплатно Гидролиз солей
Гидролиз солей Теория электролитической диссоциации
Теория электролитической диссоциации Презентация по Химии "Чипсы - вред или польза?" - скачать смотреть
Презентация по Химии "Чипсы - вред или польза?" - скачать смотреть  Закономерности взаимодействия организма и химических веществ
Закономерности взаимодействия организма и химических веществ Кам’яне вугілля Підготувала учениця 11а класу Нагайло Марта
Кам’яне вугілля Підготувала учениця 11а класу Нагайло Марта  Введение. Кристаллография
Введение. Кристаллография Плавление и кипение
Плавление и кипение Классификация процессов и производств в химической технологии
Классификация процессов и производств в химической технологии Основы коррозии и защиты металлов
Основы коррозии и защиты металлов Электрические свойства дисперсных систем. (Лекция 5)
Электрические свойства дисперсных систем. (Лекция 5) II группа периодической системы Д. И. Менделеева. Магния сульфат. Кальция хлорид
II группа периодической системы Д. И. Менделеева. Магния сульфат. Кальция хлорид Химическая связь. Электроотрицательность. Ковалентная связь
Химическая связь. Электроотрицательность. Ковалентная связь Повышение эффективности процесса сополимеризации бутадиена и α-метилстирола. Производительность 83000 т/год
Повышение эффективности процесса сополимеризации бутадиена и α-метилстирола. Производительность 83000 т/год Сіль амонію
Сіль амонію  Круговорот углерода в природе
Круговорот углерода в природе Присоединение аммиака и аминов
Присоединение аммиака и аминов Кислород. Происхождение слова Кислород
Кислород. Происхождение слова Кислород Электролиз расплавов и растворов электролитов
Электролиз расплавов и растворов электролитов Рекомендации по подготовке учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии
Рекомендации по подготовке учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии Учитель высшей категории ГОУ СОШ №26 с углубленным изучением французского языка г. Санкт-Петербурга Литвиненко Галина Андреевна
Учитель высшей категории ГОУ СОШ №26 с углубленным изучением французского языка г. Санкт-Петербурга Литвиненко Галина Андреевна Химические свойства металлов. Коррозия металлов
Химические свойства металлов. Коррозия металлов МОЮЩИЕ СРЕДСТВА СВОЙСТВА МОЮЩИХ СРЕДСТВ КЛАССИФИКАЦИЯ МОЮЩИХ СРЕДСТВ
МОЮЩИЕ СРЕДСТВА СВОЙСТВА МОЮЩИХ СРЕДСТВ КЛАССИФИКАЦИЯ МОЮЩИХ СРЕДСТВ Brain элементтері
Brain элементтері Химическое действие света
Химическое действие света