Содержание
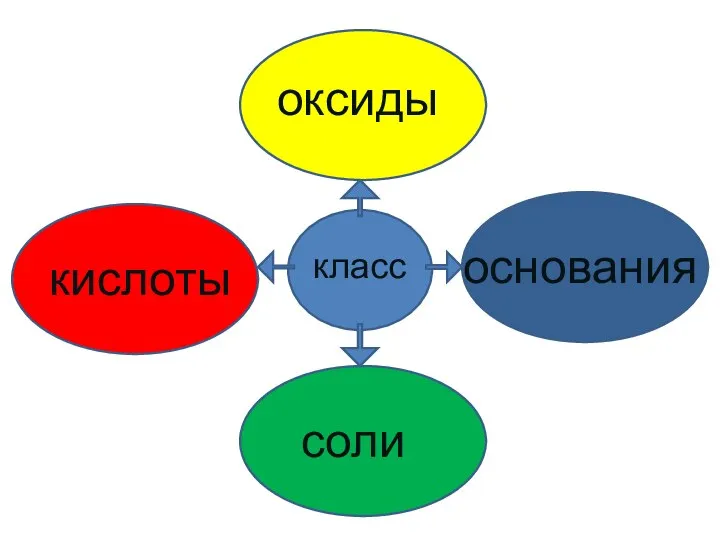
- 2. кислоты оксиды класс соли основания
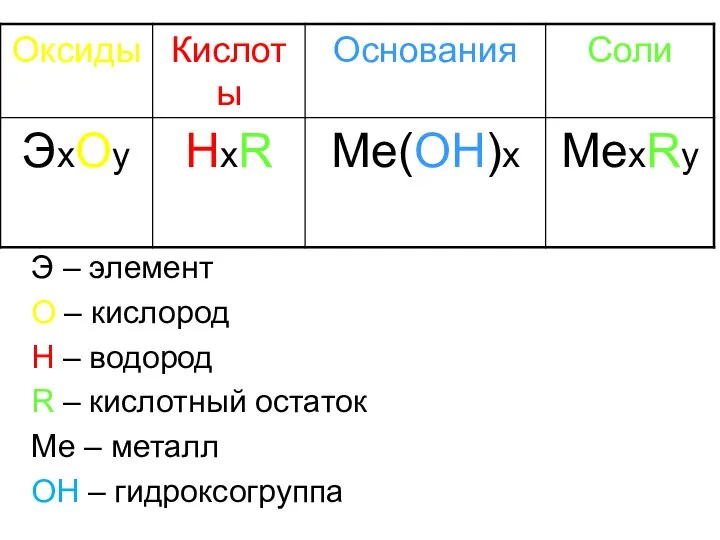
- 3. Э – элемент О – кислород Н – водород R – кислотный остаток Ме – металл
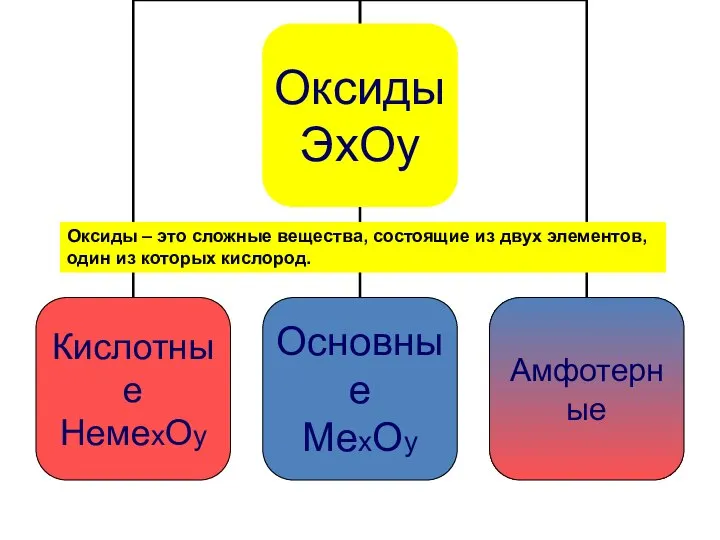
- 4. Оксиды – это сложные вещества, состоящие из двух элементов, один из которых кислород.
- 5. Основные оксиды – это оксиды металлов МехОy
- 6. Основные оксиды СаО – оксид кальция, негашеная известь. Используется как побелка. Nа2O – оксид натрия. Входит
- 7. Кислотные оксиды – это оксиды неметаллов НемеО
- 8. Оксид углерода (IV) Одной из проблем, имеющих глобальный характер, стало возрастание содержания оксида углерода (IV) в
- 9. Оксид углерода (IV) Большая часть СО2 в атмосфере образуется при использовании топлива для получения различных видов
- 10. Оксид углерода (IV) Рост концентрации оксида углерода (IV) в атмосфере вызывает повышение температуры воздуха, создавая парниковый
- 11. SO2 Один из сильнейших загрязнителей атмосферы - оксид серы (IV) Попадает в атмосферу при обжиге сульфидных
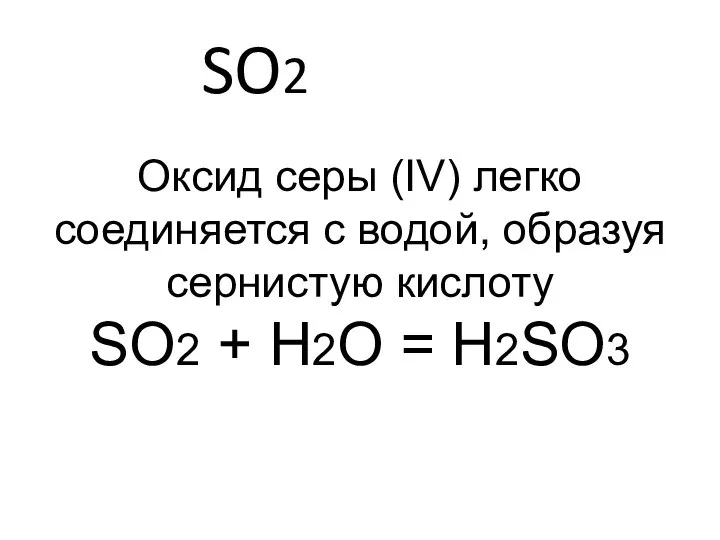
- 12. SO2 Оксид серы (IV) легко соединяется с водой, образуя сернистую кислоту SO2 + H2O = H2SO3
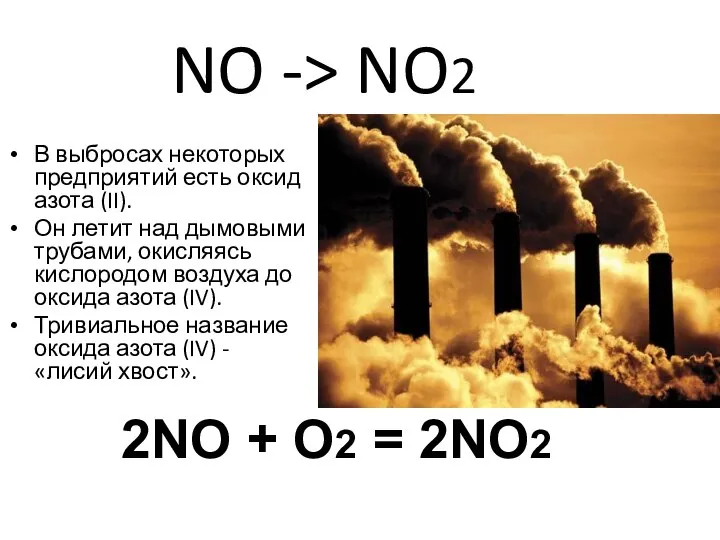
- 13. NO -> NO2 В выбросах некоторых предприятий есть оксид азота (II). Он летит над дымовыми трубами,
- 14. Оксид азота (IV) NO2 реагирует с водой с образованием азотной кислоты 3NO2 + H2O = 2HNO3
- 15. Кислотные дожди Кислотные дожди поражают растительность, губят живые организмы водоемов и почв, вызывают заболевания у людей.
- 16. Кислоты НхR Кислоты – это сложные вещества, состоящие из атомов водорода и кислотных остатков.
- 17. Соляная кислота НСl В начале 16 века Парацельс предположил, что в желудке при питье кислой воды
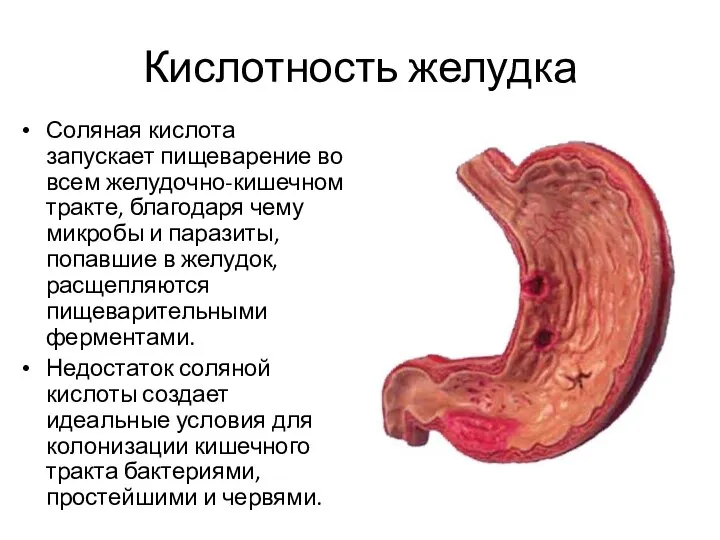
- 18. Кислотность желудка Соляная кислота запускает пищеварение во всем желудочно-кишечном тракте, благодаря чему микробы и паразиты, попавшие
- 19. Яблочная кислота Щавелевая кислота Аскорбиновая кислота Муравьиная кислота Кислоты вокруг нас
- 20. Основания Ме(ОН)х Основания – это сложные вещества, состоящие из атомов металла и гидроксогрупп
- 21. Основания МеОН Растворимые основания - щёлочи - содержатся в большом количестве в отбеливающих, моющих средствах, жидкостях
- 22. Fe(OH)2 + H2O + O2 = Fe(OH)3 Ржавчина – это гидроксид железа (III). Вещество относится к
- 23. Соли МеxRy Соли – это сложные вещества, состоящие из атомов металла и кислотных остатков
- 24. Поваренная соль NaCl Недостаток этой соли приводит к функциональным и органическим расстройствам Суточная потребность в поваренной
- 25. Химия в саду Все удобрения относятся к классу солей. Избыток и недостаток удобрений для растений равносильны
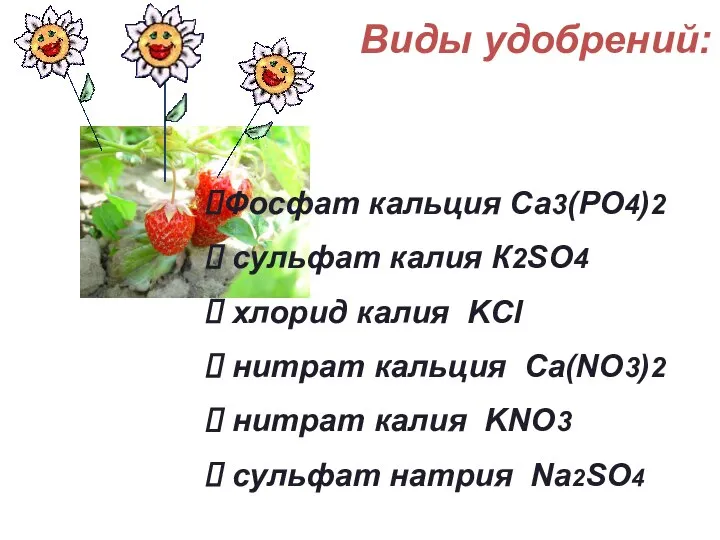
- 26. Виды удобрений: Фосфат кальция Са3(РО4)2 сульфат калия К2SO4 хлорид калия KCl нитрат кальция Ca(NO3)2 нитрат калия
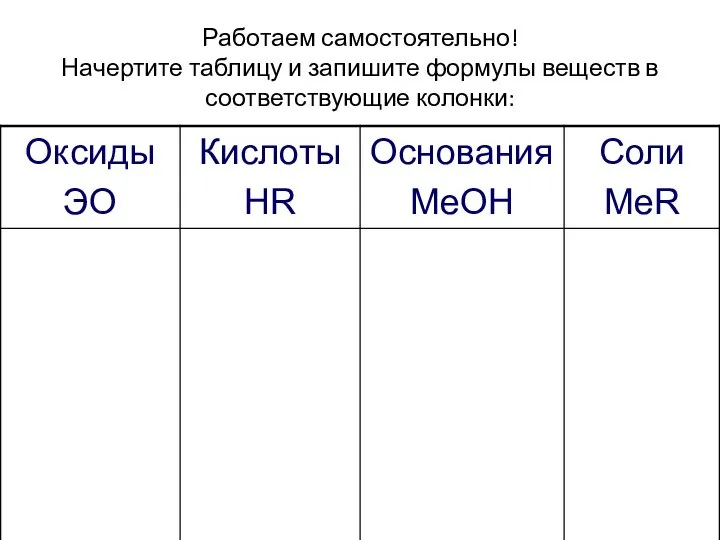
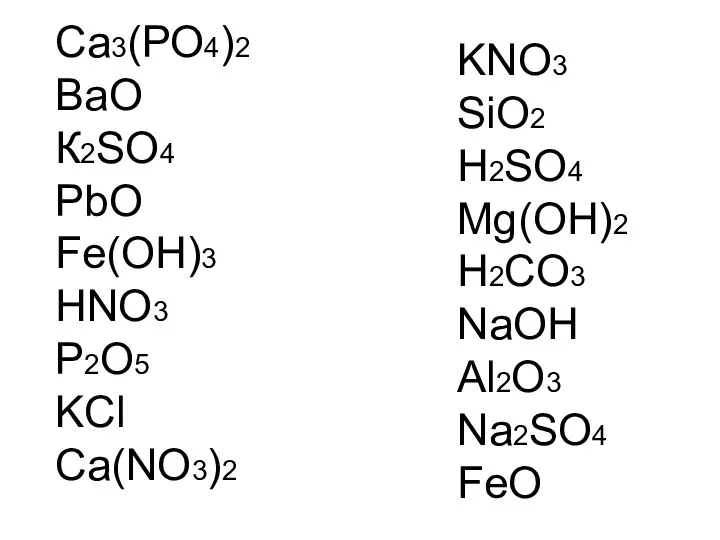
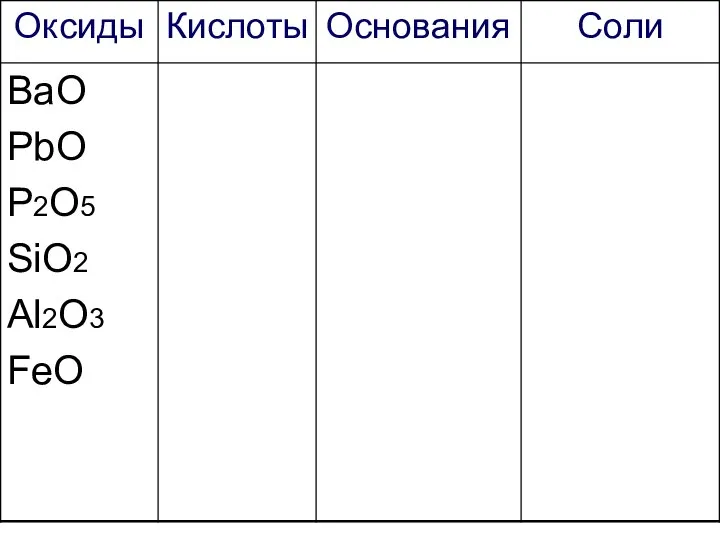
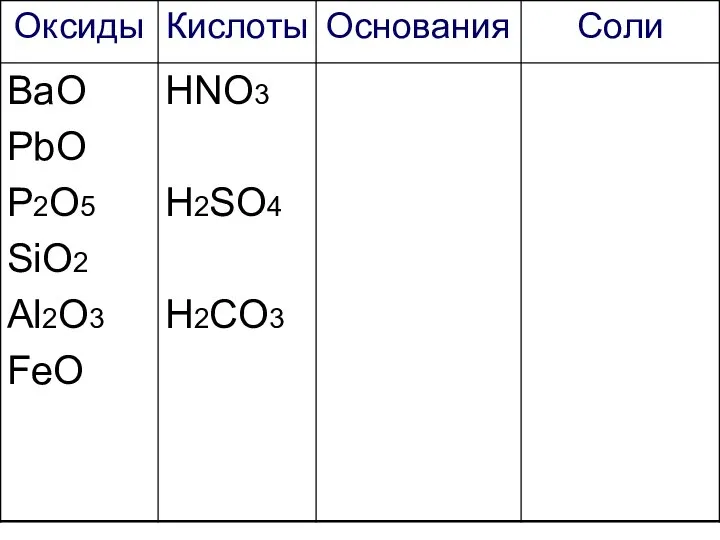
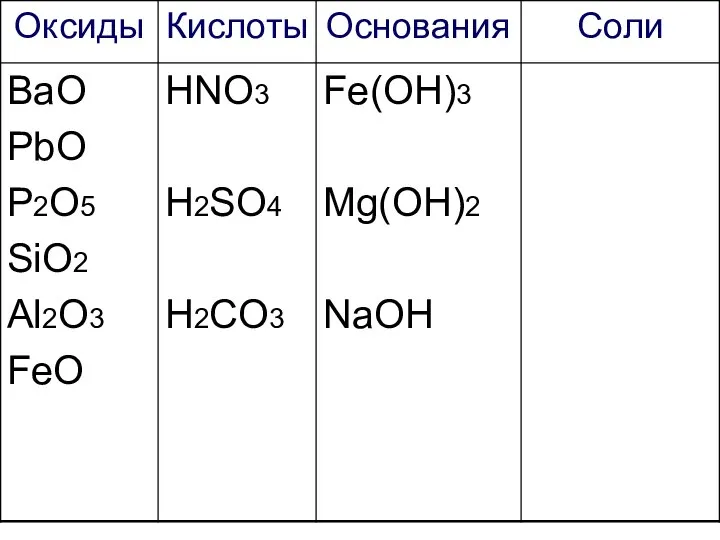
- 27. Работаем самостоятельно! Начертите таблицу и запишите формулы веществ в соответствующие колонки:
- 28. Са3(РО4)2 ВаО К2SO4 PbO Fe(OH)3 HNO3 P2O5 KCl Ca(NO3)2 KNO3 SiO2 H2SO4 Mg(OH)2 H2CO3 NaOH Al2O3
- 29. А теперь проверим, что у нас получилось! Итак…
- 34. Скачать презентацию



















 Открытый урок по химии
Открытый урок по химии Фазовая диаграмма GaAs. Ретроградная растворимость. Селективная летучесть мышьяка из расплава. Методы борьбы с этими проблемами
Фазовая диаграмма GaAs. Ретроградная растворимость. Селективная летучесть мышьяка из расплава. Методы борьбы с этими проблемами Поиск новых анальгетических средств
Поиск новых анальгетических средств СПИРТЫ
СПИРТЫ  Реакции ионного обмена. Теория химического строения органических соединений. 9 класс
Реакции ионного обмена. Теория химического строения органических соединений. 9 класс Соединения алюминия
Соединения алюминия “Green chemistry” Безпечна для довкілля
“Green chemistry” Безпечна для довкілля  Источники низших олефинов
Источники низших олефинов Гетерогенное ионное равновесие. Реакции обмена
Гетерогенное ионное равновесие. Реакции обмена Энергетические эффекты реакций
Энергетические эффекты реакций Борьба с вредителями и грызунами химическими средствам Презентацию выполнил : Коновалов Михаил Преподаватель: Холостина Натал
Борьба с вредителями и грызунами химическими средствам Презентацию выполнил : Коновалов Михаил Преподаватель: Холостина Натал Хімія числа Е в продуктах харчування
Хімія числа Е в продуктах харчування  Типы химических реакций. Реакция соединения
Типы химических реакций. Реакция соединения Будівельні матеріали: скло, цемент, бетон та їх використання. Колообіг Оксигену,Нітрогену,Карбону в природі. Підготувала учен
Будівельні матеріали: скло, цемент, бетон та їх використання. Колообіг Оксигену,Нітрогену,Карбону в природі. Підготувала учен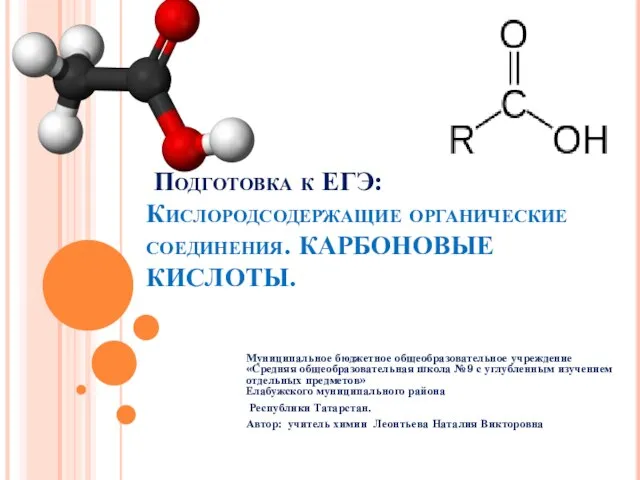 Подготовка к ЕГЭ: Кислородсодержащие органические соединения. КАРБОНОВЫЕ КИСЛОТЫ. Муниципальное бюджетное общеобразовательное
Подготовка к ЕГЭ: Кислородсодержащие органические соединения. КАРБОНОВЫЕ КИСЛОТЫ. Муниципальное бюджетное общеобразовательное  Элементы химической термодинамики и биоэнергетики
Элементы химической термодинамики и биоэнергетики Строение газообразных, жидких и твёрдых тел
Строение газообразных, жидких и твёрдых тел Бериллий, магний, щелочноземельные металлы
Бериллий, магний, щелочноземельные металлы Презентация по Химии "Вода" - скачать смотреть
Презентация по Химии "Вода" - скачать смотреть  Анилин. Физические свойства
Анилин. Физические свойства Соли аммония
Соли аммония Вода – основа жизни на Земле
Вода – основа жизни на Земле Презентация Строение Бензола
Презентация Строение Бензола Колообіг нітрогену Колообіг речовин — основна властивість, характерна риса біосфери.
Колообіг нітрогену Колообіг речовин — основна властивість, характерна риса біосфери.  Главная подгруппа V группы. Фосфор
Главная подгруппа V группы. Фосфор Тест 1.Тип кристаллической решетки у белого фосфора…. а) молекулярный б) атомный в) ионный а) молекулярный Р4 2. У фосфора…..
Тест 1.Тип кристаллической решетки у белого фосфора…. а) молекулярный б) атомный в) ионный а) молекулярный Р4 2. У фосфора…..  Ковалентная связь
Ковалентная связь Закон сохранения массы веществ. Уравнения химических реакций
Закон сохранения массы веществ. Уравнения химических реакций