Содержание
- 2. Хімічне рівняння — це скорочений запис хімічної реакції хімічними символами елементів і хімічними формулами речовин. Хімічна
- 3. Кожне хімічне рівняння складається з правої і лівої частин, сполучених між собою знаком рівності. У лівій
- 4. Перші формулювання цього закону ще в І ст. до н.е., зустрічаємо, наприклад у відомій роботі Лукреція
- 5. “… всі зміни, що трапляються в натурі, такого суть стану, що скільки чого в одного тіла
- 6. 1789 року Антуан Лавуаз'є ясно й однозначно сформулював цей закон так: “маса (вага) речовин, що вступають
- 7. Щоб зобразити реакцію хімічним рівнянням, зовсім не обов'язково вказувати всю кількість реагуючих молекул і атомів. Для
- 9. Скачать презентацию
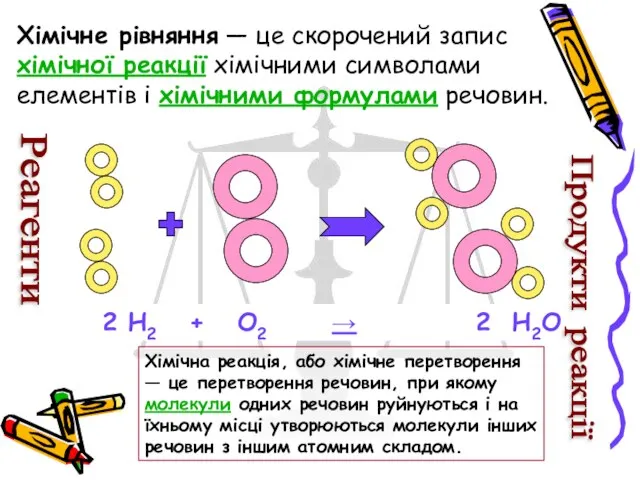
Хімічне рівняння — це скорочений запис хімічної реакції хімічними символами елементів
Хімічне рівняння — це скорочений запис хімічної реакції хімічними символами елементів
Хімічна реакція, або хімічне перетворення — це перетворення речовин, при якому молекули одних речовин руйнуються і на їхньому місці утворюються молекули інших речовин з іншим атомним складом.
2 H2 + O2 → 2 H2O
Реагенти
Продукти реакції
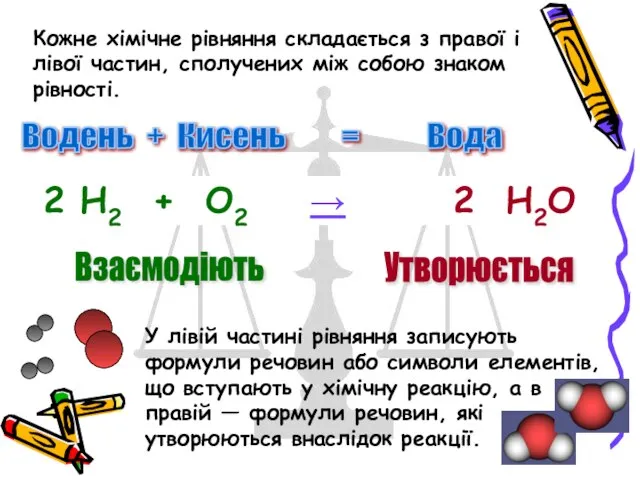
Кожне хімічне рівняння складається з правої і лівої частин, сполучених між
Кожне хімічне рівняння складається з правої і лівої частин, сполучених між
У лівій частині рівняння записують формули речовин або символи елементів, що вступають у хімічну реакцію, а в правій — формули речовин, які утворюються внаслідок реакції.
Водень + Кисень = Вода
2 H2 + O2 → 2 H2O
Взаємодіють
Утворюється
Перші формулювання цього закону ще в І ст.
до н.е., зустрічаємо,
Перші формулювання цього закону ще в І ст.
до н.е., зустрічаємо,
(лат. De rerum natura).
Закон збереження маси речовини — відомий з давніх давен.
Зображення хімічних реакцій
хімічними рівняннями базується на
законі збереження маси речовини, за яким загальна кількість атомів кожного елементу
під час реакції залишається незмінною.
n(X,Z,Y) = n(Y,Z,X)
2О3
3О2
“… всі зміни, що трапляються в натурі, такого суть стану, що
“… всі зміни, що трапляються в натурі, такого суть стану, що
Саме тут принцип збереження маси речовини у фізичних і хімічних перетвореннях вперше на лекціях почув Михайло Ломоносов, — згодом відомий російський вчений, — який вчився тут у юнацькі роки.
У нові часи (пізнє середньовіччя) Закон збереження маси речовини у різних формах подається рядом вчених. Так, у Києво-Могилянській академії його вперше формулює професор академії і її ректор
Інокентій Гізель (1600 – 1683)
1789 року Антуан Лавуаз'є ясно й однозначно сформулював цей закон так:
“маса
1789 року Антуан Лавуаз'є ясно й однозначно сформулював цей закон так:
“маса
що вступають в реакцію,
завжди дорівнює масі (вазі) речовин,
які утворюються в результаті реакції.”
Цей закон є основним для хімії і всього природознавства і для хімії – зокрема.
Йому підлягають всі хімічні перетворення, що відбуваються в природі і техніці.
На ньому ґрунтуються усі розрахунки в хімії.
m(X,Z,Y) = m(Y,Z,X)
m(реагентів) = m(продуктів)
Щоб зобразити реакцію хімічним рівнянням, зовсім не обов'язково вказувати всю кількість
Щоб зобразити реакцію хімічним рівнянням, зовсім не обов'язково вказувати всю кількість
Коефіцієнти в обох частинах хімічного рівняння можна збільшувати або зменшувати в однакове число разів :
200 H2 + 100 O2 → 200 H2O
100 H2 + 50 O2 → 100 H2O
2 H2 + O2 → 2 H2O




 Нуклеофилы и электрофилы. Лекция 2
Нуклеофилы и электрофилы. Лекция 2 «Влияние талой воды на прорастание семян» Учащаяся 10 класса Гончарова Евгения Руководитель Григенча Т
«Влияние талой воды на прорастание семян» Учащаяся 10 класса Гончарова Евгения Руководитель Григенча Т Необычные минералы
Необычные минералы Атомно-емісійна спектрометрія з індуктивно-зв’язаною плазмою та рентгенофлуоресцентний аналіз
Атомно-емісійна спектрометрія з індуктивно-зв’язаною плазмою та рентгенофлуоресцентний аналіз Строение, свойства и многообразие функций белков
Строение, свойства и многообразие функций белков Apa în natură. Resursele de apă
Apa în natură. Resursele de apă Засоби побутової хімії – небезпечні джерела шкідливих для здоров’я людини речовин.
Засоби побутової хімії – небезпечні джерела шкідливих для здоров’я людини речовин.  Воздух, его состав и значение
Воздух, его состав и значение Содержание аскорбиновой кислоты в плодах шиповника, разных видов консервации
Содержание аскорбиновой кислоты в плодах шиповника, разных видов консервации Титан и его сплавы
Титан и его сплавы Полимеризация циклов. Сополимеризация
Полимеризация циклов. Сополимеризация Обмен простых белков. Дезаминирование и трансаминирование аминокислот
Обмен простых белков. Дезаминирование и трансаминирование аминокислот Изучение биохимических свойств микробов и их чувствительность к антибиотикам. Микробиологические исследования воды
Изучение биохимических свойств микробов и их чувствительность к антибиотикам. Микробиологические исследования воды Строение вещества
Строение вещества Składniki odżywcze
Składniki odżywcze Аллотропные модификации. Углерод
Аллотропные модификации. Углерод Презентация по Химии "Растворимость веществ в воде" - скачать смотреть
Презентация по Химии "Растворимость веществ в воде" - скачать смотреть  Растворы ВМС
Растворы ВМС Свойства химических элементов I и II А подгрупп периодической системы Д.И. Менделеева
Свойства химических элементов I и II А подгрупп периодической системы Д.И. Менделеева Основания, кислоты, соли в свете ТЭД
Основания, кислоты, соли в свете ТЭД КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КУБАНСКИЙ МЕДИЦИНСКИЙ ИНСТИТУТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМ
КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КУБАНСКИЙ МЕДИЦИНСКИЙ ИНСТИТУТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМ Классификация методов аналитической химии
Классификация методов аналитической химии Модифицированные природные полимеры. Их свойства
Модифицированные природные полимеры. Их свойства Кремний. Химические свойства
Кремний. Химические свойства Важнейшие классы бинарных соединений. Оксиды, гидриды и летучие водородные соединения
Важнейшие классы бинарных соединений. Оксиды, гидриды и летучие водородные соединения КАЛЬЦИЙ учитель: Дерюжина Алеся Владимировна Alesya2312@nextmail.ru МОУ «Гимназия №4» г.о. Электросталь, МО Ca 9 класс
КАЛЬЦИЙ учитель: Дерюжина Алеся Владимировна Alesya2312@nextmail.ru МОУ «Гимназия №4» г.о. Электросталь, МО Ca 9 класс  Количество вещества. Молярная масса. Задачи
Количество вещества. Молярная масса. Задачи Важнейшие химические понятия и законы
Важнейшие химические понятия и законы