Содержание
- 2. Идеальный газ Известно, что частицы в газах, в отличие от жидкостей и твердых тел, располагаются друг
- 3. Основные отличия идеального газа от реального газа: 1. Размеры молекул малы по сравнению с расстояниями между
- 4. 5. Молекулы распределены по всему объему равномерно. 6. Молекулы движутся хаотично,то есть все направления движений равноправны.
- 5. Реальные разреженные газы действительно ведут себя подобно идеальному газу. Вследствие теплового движения, частицы газа время от
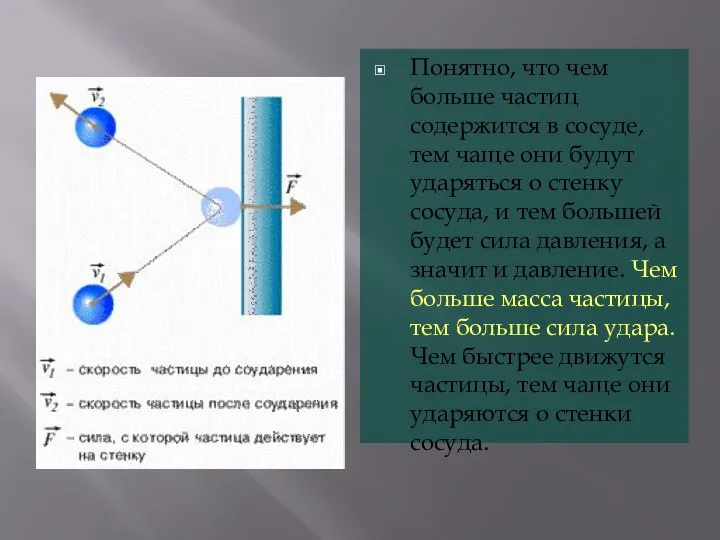
- 6. Понятно, что чем больше частиц содержится в сосуде, тем чаще они будут ударяться о стенку сосуда,
- 7. Сила, с которой молекулы действуют на стенку сосуда, прямо пропорциональна числу молекул, содержащихся в единице объема
- 9. Скачать презентацию





 Презентация по Химии "Дмитро Менделєєв" - скачать смотреть бесплатно
Презентация по Химии "Дмитро Менделєєв" - скачать смотреть бесплатно Атомы химических элементов
Атомы химических элементов Азот. Соединения азота
Азот. Соединения азота Презентация по Химии "Открытия в химии XXI века. OLED – живое изображение" - скачать смотреть
Презентация по Химии "Открытия в химии XXI века. OLED – живое изображение" - скачать смотреть  Химия гетероциклических соединений. Трехчленные циклы
Химия гетероциклических соединений. Трехчленные циклы Чистые вещества и смеси
Чистые вещества и смеси Природные полимеры и продукты их химических превращений
Природные полимеры и продукты их химических превращений Тіршілік гетерофункционалды қосылыстар
Тіршілік гетерофункционалды қосылыстар Строение, свойства, биологическая роль нуклеотидов. (Лекция 5)
Строение, свойства, биологическая роль нуклеотидов. (Лекция 5) Углеводороды. Структура и функции биолекул
Углеводороды. Структура и функции биолекул Жартылый өткізгіштікке ие химиялық элементтер
Жартылый өткізгіштікке ие химиялық элементтер Адсорбционные взаимодействия
Адсорбционные взаимодействия Газ тәрізді өнімдер бромды сутек
Газ тәрізді өнімдер бромды сутек Қатты материалдарды ұнтақтау, елеу және араластыру. Машиналар мен аппараттар
Қатты материалдарды ұнтақтау, елеу және араластыру. Машиналар мен аппараттар Основания LiOH - гидроксид лития
Основания LiOH - гидроксид лития Алюминий
Алюминий  Одноатомные спирты
Одноатомные спирты Степень окисления
Степень окисления  Основные показатели свойств жидкостей (урок № 3.1)
Основные показатели свойств жидкостей (урок № 3.1) Evolution of Isoconversional Methods
Evolution of Isoconversional Methods Металлы побочных подгрупп. Марганец. Хром. (Лекция 15)
Металлы побочных подгрупп. Марганец. Хром. (Лекция 15) Никель қаптамаларын алу жолдары
Никель қаптамаларын алу жолдары Определение содержания солей в нефти
Определение содержания солей в нефти Қышқылды-сілтілі тепетеңдік бұзылысының клиникалық биохимиясы
Қышқылды-сілтілі тепетеңдік бұзылысының клиникалық биохимиясы Бутан как хладагент
Бутан как хладагент Теория химико-технологических процессов органического синтеза. Введение. (Лекция 1)
Теория химико-технологических процессов органического синтеза. Введение. (Лекция 1) Применение неметаллов и их соединений
Применение неметаллов и их соединений Термодинамика химических процессов
Термодинамика химических процессов