Слайд 13

Испытание на чистоту:
2,5 г препарата растворяют в 50 мл воды.
2 мл этого раствора, разбавление водой до 10 мл, не должны содержать хлоридов более чем 10 мл эталонного раствора, т.е не более 0,02% в препарате.
10 мл того же раствора не должны содержать сульфатов более чем 10 мл эталонного раствора, т.е не более 0,02% в препарате.
10 мл того же раствора не должны содержать железа более чем 10 мл эталонного раствора, т.е. не более 0,006% в препарате.
10 мл того же раствора не должны давать реакции на тяжелые металлы.
0,6 г препарата, растворенные в 10 мл воды, не должны содержать кальция более чем 10 мл эталонного раствора, т.е не более 0,05% в препарате.
При нагревании 1,0 препарата с 10 мл раствора едкого натра выделяются пары не должны окрашивать красную лакмусовую бумагу в синий цвет (соли аммония).
0,5 г препарата не должны содержать мышьяка более чем 1 мл эталонного раствора , т. е. не более чем 0,0002% в препарате.

















 Фотохимический смог
Фотохимический смог Слайд-шоу
Слайд-шоу Физико-химические свойства нефтей и нефтепродуктов
Физико-химические свойства нефтей и нефтепродуктов Cера как представитель халькогенов
Cера как представитель халькогенов Азотная кислота – HNO3 – «взрывоопасная царская особа» МБОУ «Рождественская средняя общеобразовательная школа» Собинско
Азотная кислота – HNO3 – «взрывоопасная царская особа» МБОУ «Рождественская средняя общеобразовательная школа» Собинско Именные реакции в органической химии
Именные реакции в органической химии Гидролиз солей
Гидролиз солей Жёсткость воды и способы её устранения
Жёсткость воды и способы её устранения Дисперсные наполнители. Пневмогидрокомпрессионное формование. Магнитоимпульсное формование
Дисперсные наполнители. Пневмогидрокомпрессионное формование. Магнитоимпульсное формование Галогенопроизводные углеводородов. (Лекция 8)
Галогенопроизводные углеводородов. (Лекция 8) Ионный обмен или сорбция
Ионный обмен или сорбция «ШАРИКИ СЧАСТЬЯ» Неустроева Светлана Габдульхатовна, учитель I категории, МБОУ «СОШ №31», г.Нижнекамск
«ШАРИКИ СЧАСТЬЯ» Неустроева Светлана Габдульхатовна, учитель I категории, МБОУ «СОШ №31», г.Нижнекамск Илік заттар (немесе тұтқыр заттар), тітіркендіруші заттар.қаптаушы заттар, адсорбциялаушы заттар
Илік заттар (немесе тұтқыр заттар), тітіркендіруші заттар.қаптаушы заттар, адсорбциялаушы заттар Характеристика 1-й аналитической группы анионов
Характеристика 1-й аналитической группы анионов Драгоценные камни
Драгоценные камни Презентация по Химии "«Сахароза»" - скачать смотреть бесплатно
Презентация по Химии "«Сахароза»" - скачать смотреть бесплатно Весь смысл жизни заключается в бесконечном завоевании неизвестного, в вечном усилии познать больше Эмиль Золя
Весь смысл жизни заключается в бесконечном завоевании неизвестного, в вечном усилии познать больше Эмиль Золя 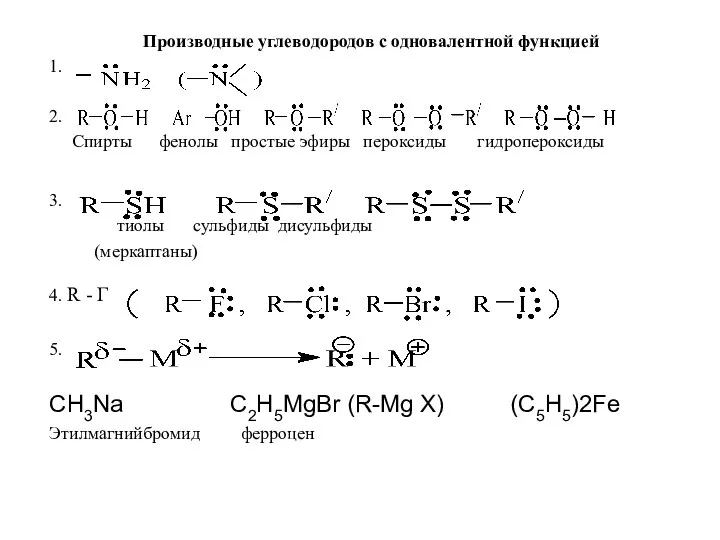 Производные углеводородов с одновалентной функцией
Производные углеводородов с одновалентной функцией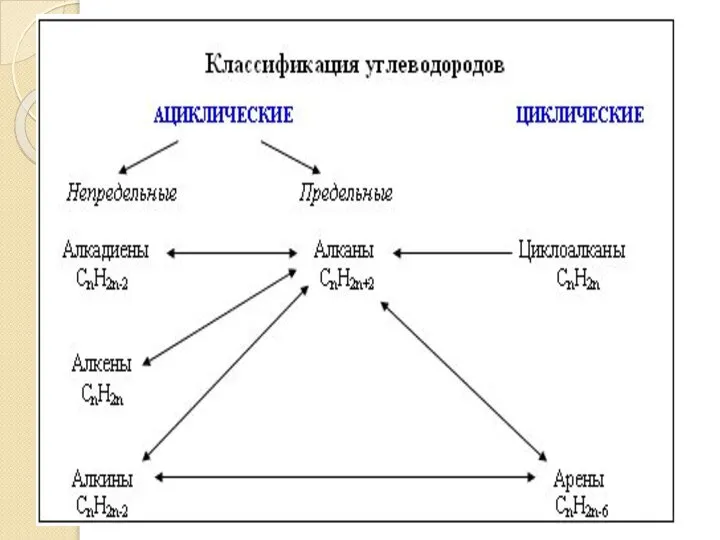 Классификация углеводородов
Классификация углеводородов Металлы. Общая характеристика металлов и их свойства
Металлы. Общая характеристика металлов и их свойства Жиры – биологически важные органические соединения Работа ученицы 11а класса МБОУ СОШ № 26 Ногинского района Московской области
Жиры – биологически важные органические соединения Работа ученицы 11а класса МБОУ СОШ № 26 Ногинского района Московской области  Обобщающий урок по теме: «Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома»
Обобщающий урок по теме: «Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома» Презентация по Химии "Железо" - скачать смотреть
Презентация по Химии "Железо" - скачать смотреть  Сульфаниламидные препараты. (Тема 5)
Сульфаниламидные препараты. (Тема 5) Нитрид индия – новый материал для оптоэлектроники
Нитрид индия – новый материал для оптоэлектроники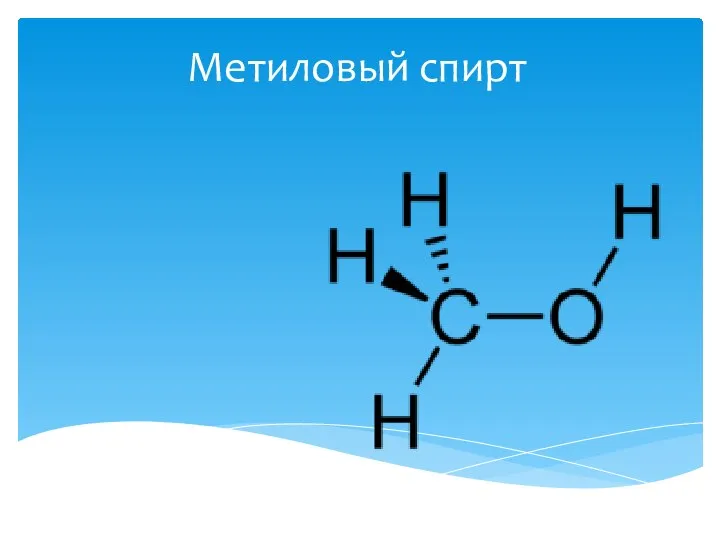 Метиловый спирт
Метиловый спирт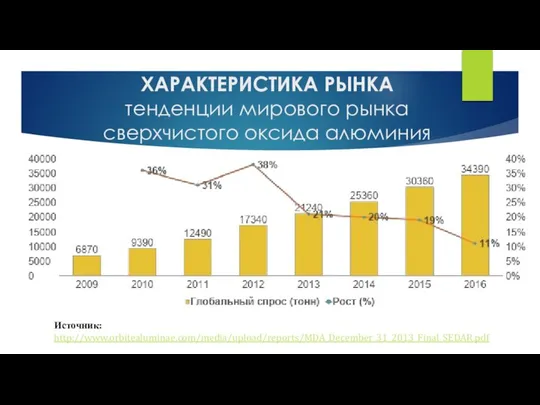 Характеристика рынка. Тенденции мирового рынка сверхчистого оксида алюминия
Характеристика рынка. Тенденции мирового рынка сверхчистого оксида алюминия Макро- и микроэлементы
Макро- и микроэлементы