Содержание
- 2. Карбоновые кислоты — класс органических соединений, молекулы которого содержат карбоксильную группу - COOH. Состав предельных одноосновных
- 3. Классификация По числу карбоксильных групп карбоновые кислоты делятся на: монокарбоновые или одноосновные (уксусная кислота) дикарбоновые или
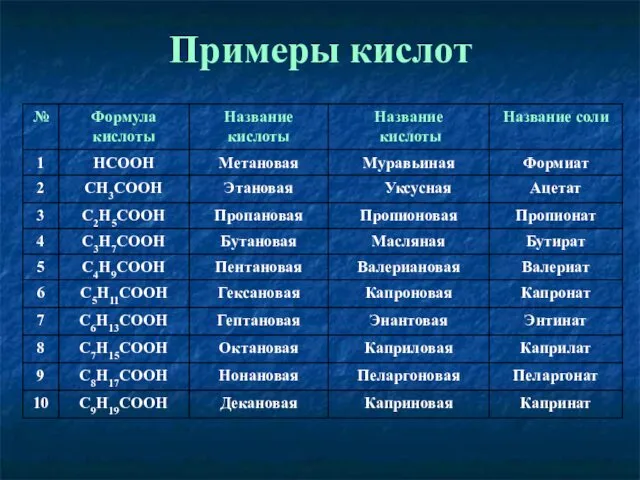
- 4. Примеры кислот
- 5. Изомерия 1.Изомерия углеродной цепи. 2. Изомерия положения кратной связи, например: СН2=СН—СН2—СООН Бутен-3-овая кислота (винилуксусная кислота) СН3—СН=СН—СООН
- 6. Строение Карбоксильная группа СООН состоит из карбонильной группы С=О и гидроксильной группы ОН. В группе СО
- 7. Физические и химические свойства Низшие карбоновые кислоты — жидкости с острым запахом, хорошо растворимые в воде.
- 8. 3) Взаимодействие с основаниями: CH3COOH + NaOH CH3COONa + H2O 4) Взаимодействие с солями: CH3COOH +
- 9. Способы получения Окисление альдегидов и первичных спиртов — общий способ получения карбоновых кислот: 2. Другой общий
- 10. 4. Гидролиз сложных эфиров: 5. Гидролиз ангидридов кислот:
- 11. Специфические способы получения Для отдельных кислот существуют специфические способы получения: Для получения бензойной кислоты можно использовать
- 12. Применение карбоновых кислот Клей Гербициды Консервант, приправа Парфюмерия, косметика Искусственные волокна
- 13. Задача. Напишите уравнения реакций, соответствующие следующей схеме:
- 15. Скачать презентацию











 Презентация по Химии "Дмитро Менделєєв" - скачать смотреть бесплатно
Презентация по Химии "Дмитро Менделєєв" - скачать смотреть бесплатно Атомы химических элементов
Атомы химических элементов Азот. Соединения азота
Азот. Соединения азота Презентация по Химии "Открытия в химии XXI века. OLED – живое изображение" - скачать смотреть
Презентация по Химии "Открытия в химии XXI века. OLED – живое изображение" - скачать смотреть  Химия гетероциклических соединений. Трехчленные циклы
Химия гетероциклических соединений. Трехчленные циклы Чистые вещества и смеси
Чистые вещества и смеси Природные полимеры и продукты их химических превращений
Природные полимеры и продукты их химических превращений Тіршілік гетерофункционалды қосылыстар
Тіршілік гетерофункционалды қосылыстар Строение, свойства, биологическая роль нуклеотидов. (Лекция 5)
Строение, свойства, биологическая роль нуклеотидов. (Лекция 5) Углеводороды. Структура и функции биолекул
Углеводороды. Структура и функции биолекул Жартылый өткізгіштікке ие химиялық элементтер
Жартылый өткізгіштікке ие химиялық элементтер Адсорбционные взаимодействия
Адсорбционные взаимодействия Газ тәрізді өнімдер бромды сутек
Газ тәрізді өнімдер бромды сутек Қатты материалдарды ұнтақтау, елеу және араластыру. Машиналар мен аппараттар
Қатты материалдарды ұнтақтау, елеу және араластыру. Машиналар мен аппараттар Основания LiOH - гидроксид лития
Основания LiOH - гидроксид лития Алюминий
Алюминий  Одноатомные спирты
Одноатомные спирты Степень окисления
Степень окисления  Основные показатели свойств жидкостей (урок № 3.1)
Основные показатели свойств жидкостей (урок № 3.1) Evolution of Isoconversional Methods
Evolution of Isoconversional Methods Металлы побочных подгрупп. Марганец. Хром. (Лекция 15)
Металлы побочных подгрупп. Марганец. Хром. (Лекция 15) Никель қаптамаларын алу жолдары
Никель қаптамаларын алу жолдары Определение содержания солей в нефти
Определение содержания солей в нефти Қышқылды-сілтілі тепетеңдік бұзылысының клиникалық биохимиясы
Қышқылды-сілтілі тепетеңдік бұзылысының клиникалық биохимиясы Бутан как хладагент
Бутан как хладагент Теория химико-технологических процессов органического синтеза. Введение. (Лекция 1)
Теория химико-технологических процессов органического синтеза. Введение. (Лекция 1) Применение неметаллов и их соединений
Применение неметаллов и их соединений Термодинамика химических процессов
Термодинамика химических процессов