Содержание
- 2. Строение атомов и степени окисления Халькогены – элементы главной подгруппы VI группы. На внешнем энергетическом уровне
- 3. Простые вещества
- 4. Химические свойства простых веществ
- 5. Химические свойства простых веществ 3) Взаимодействие со сложными веществами Кислород окисляет невысшие оксиды, сульфиды, карбиды и
- 6. Сероводород и сульфиды Сероводород H2S – бесцветный газ с запахом тухлых яиц, ядовитый, мало растворим в
- 7. Перекись водорода и пероксиды H2O2 Перекись водорода – бесцветная жидкость, вязкая , неограниченно смешивается с водой.
- 8. Сернистый газ (S+4) SO2 – бесцветный газ с резким запахом жженой серы, ядовитый, растворим в воде
- 9. Серная кислота, серный ангидрид (S+6)
- 10. Химические свойства серной кислоты 1) Разбавленная серная кислота проявляет обычные кислотные свойства H2SO4 + Fe= H2
- 12. Скачать презентацию
Слайд 2
Строение атомов и степени окисления
Халькогены – элементы главной подгруппы VI
Строение атомов и степени окисления
Халькогены – элементы главной подгруппы VI
группы.
На внешнем энергетическом уровне они содержат по 6 электронов.
У атомов всех халькогенов, кроме кислорода, в возбужденном состоянии увеличивается количество неспаренных электронов, поэтому они могут проявлять степени окисления
+4 и +6.
O: 2s22p4 S, Se, Te: ns2 np4 nd0
+6 SO3, H2SO4
+4 SO2, H2SO3
+2 OF2 +2 SCl2
+1 O2F2
0 O2, O3 0 S
-1 H2O2, Na2O2 -1 FeS2
-2 O2- -2 H2S, S2-
На внешнем энергетическом уровне они содержат по 6 электронов.
У атомов всех халькогенов, кроме кислорода, в возбужденном состоянии увеличивается количество неспаренных электронов, поэтому они могут проявлять степени окисления
+4 и +6.
O: 2s22p4 S, Se, Te: ns2 np4 nd0
+6 SO3, H2SO4
+4 SO2, H2SO3
+2 OF2 +2 SCl2
+1 O2F2
0 O2, O3 0 S
-1 H2O2, Na2O2 -1 FeS2
-2 O2- -2 H2S, S2-
Слайд 3
Простые вещества
Простые вещества
Слайд 4
Химические свойства простых веществ
Химические свойства простых веществ
Слайд 5
Химические свойства простых веществ
3) Взаимодействие со сложными веществами
Кислород окисляет невысшие оксиды,
Химические свойства простых веществ
3) Взаимодействие со сложными веществами
Кислород окисляет невысшие оксиды,
сульфиды, карбиды и водородные соединения:
2Cu2+1O + O2 = 4Cu+2O
2P2S3-2 + 11O2 = 2P2O5 + 6S+4O2
Al4C3-4 + 6O2 = 2Al2O3 + 3C+4O2
CH4 + 2O2 = CO2 + H2O
4) Сера диспропорционирует при кипячении в щелочи:
3S0 + 6KOH = 2K2S-2 + K2S+4O3 + 3H2O;
реагирует с разнообразными окислителями:
3S0 + 2K2Cr2O7 + 8H2SO4 = 3S+4O2 + 2K2SO4 + 2Cr2(SO4)3 + 8H2O
S0 + 6HNO3(конц.) → H2S+6O4 + 6NO2 + 2H2O
2Cu2+1O + O2 = 4Cu+2O
2P2S3-2 + 11O2 = 2P2O5 + 6S+4O2
Al4C3-4 + 6O2 = 2Al2O3 + 3C+4O2
CH4 + 2O2 = CO2 + H2O
4) Сера диспропорционирует при кипячении в щелочи:
3S0 + 6KOH = 2K2S-2 + K2S+4O3 + 3H2O;
реагирует с разнообразными окислителями:
3S0 + 2K2Cr2O7 + 8H2SO4 = 3S+4O2 + 2K2SO4 + 2Cr2(SO4)3 + 8H2O
S0 + 6HNO3(конц.) → H2S+6O4 + 6NO2 + 2H2O
Слайд 6
Сероводород и сульфиды
Сероводород H2S – бесцветный газ с запахом тухлых
Сероводород и сульфиды
Сероводород H2S – бесцветный газ с запахом тухлых
яиц, ядовитый, мало растворим в воде с образованием слабой сероводородной кислоты.
Химические свойства сероводорода
1) Кислотные
Сероводород проявляет слабые кислотные свойства, при взаимодействии со щелочами может образовывать кислые или средние соли.
H2S + 2NaOH(изб) = Na2S + 2H2O
H2S + NaOH(нед) = NaHS + H2O
При взаимодействии с солями меди, свинца или серебра образует черные осадки, нерастворимые в обычных кислотах:
H2S + Pb(NO3)2 = PbS↓ + 2HNO3
2) Восстановительные свойства
В окислительно-восстановительных реакциях сероводород всегда является восстановителем и обычно окисляется до серы или сернистого газа:
2H2S-2 + 3O2(изб.) = 2S+4O2 + 2H2O
2H2S-2 + O2(нед.) = 2S0 + 2H2O
2H2S-2 + SO2 = 3S0 + 2H2O
3H2S-2 + 2KMnO4 = 3S0 + 2MnO2 + 2KOH + 2H2O
Химические свойства сероводорода
1) Кислотные
Сероводород проявляет слабые кислотные свойства, при взаимодействии со щелочами может образовывать кислые или средние соли.
H2S + 2NaOH(изб) = Na2S + 2H2O
H2S + NaOH(нед) = NaHS + H2O
При взаимодействии с солями меди, свинца или серебра образует черные осадки, нерастворимые в обычных кислотах:
H2S + Pb(NO3)2 = PbS↓ + 2HNO3
2) Восстановительные свойства
В окислительно-восстановительных реакциях сероводород всегда является восстановителем и обычно окисляется до серы или сернистого газа:
2H2S-2 + 3O2(изб.) = 2S+4O2 + 2H2O
2H2S-2 + O2(нед.) = 2S0 + 2H2O
2H2S-2 + SO2 = 3S0 + 2H2O
3H2S-2 + 2KMnO4 = 3S0 + 2MnO2 + 2KOH + 2H2O
Слайд 7
Перекись водорода и пероксиды
H2O2 Перекись водорода – бесцветная жидкость, вязкая
Перекись водорода и пероксиды
H2O2 Перекись водорода – бесцветная жидкость, вязкая
,
неограниченно смешивается с водой.
Химические свойства перекиси водорода и пероксидов
1) Разложение на свету, при нагревании или под действием катализатора
2H2O2 = 2H2O + O2
2Na2O2 + 2H2O → 4NaOH + O2
2) Окислительно- восстановительные свойства
Перекись водорода проявляет и восстановительные, и окислительные свойства:
2KMnO4 + 5H2O2-1 + 3H2SO4 = 2MnSO4 + K2SO4 + 8H2O + 5O20↑
2Fe(OH)2 + H2O2-1 = Fe(O-2H)3
PbS + 4H2O2-1 = PbSO4 + 4H2O-2
Получение перекиси водорода
Получить перекись водорода можно гидролизом пероксидов металлов
в холодной воде:
Na2O2 + 2H2O = 2NaOH + H2O2
неограниченно смешивается с водой.
Химические свойства перекиси водорода и пероксидов
1) Разложение на свету, при нагревании или под действием катализатора
2H2O2 = 2H2O + O2
2Na2O2 + 2H2O → 4NaOH + O2
2) Окислительно- восстановительные свойства
Перекись водорода проявляет и восстановительные, и окислительные свойства:
2KMnO4 + 5H2O2-1 + 3H2SO4 = 2MnSO4 + K2SO4 + 8H2O + 5O20↑
2Fe(OH)2 + H2O2-1 = Fe(O-2H)3
PbS + 4H2O2-1 = PbSO4 + 4H2O-2
Получение перекиси водорода
Получить перекись водорода можно гидролизом пероксидов металлов
в холодной воде:
Na2O2 + 2H2O = 2NaOH + H2O2
Слайд 8
Сернистый газ (S+4)
SO2 – бесцветный газ с резким запахом жженой серы,
Сернистый газ (S+4)
SO2 – бесцветный газ с резким запахом жженой серы,
ядовитый,
растворим в воде с образованием слабой неустойчивой сернистой кислоты.
Химические свойства сернистого газа
1) Как кислотный оксид
H2O + SO2 ↔ H2SO3
Na2O + SO2 = Na2SO3
2NaOH(изб) + SO2 = Na2SO3 + H2O
NaOH(нед) + SO2 = NaHSO3
2) Окислительно-восстановительные свойства
В окислительно-восстановительных реакциях сернистый газ обычно проявляет восстановительные свойства:
2S+4O2 + O2 ↔ 2S+6O3 (кат. V2O5)
3S +4O2 + 2KMnO4 + 2H2O = 2MnO2 + K2S+6O4 + 2H2SO4
В реакции с сероводородом проявляет окислительные свойства:
S+4O2 + 2H2S-2 = 3S0 + 2H2O
растворим в воде с образованием слабой неустойчивой сернистой кислоты.
Химические свойства сернистого газа
1) Как кислотный оксид
H2O + SO2 ↔ H2SO3
Na2O + SO2 = Na2SO3
2NaOH(изб) + SO2 = Na2SO3 + H2O
NaOH(нед) + SO2 = NaHSO3
2) Окислительно-восстановительные свойства
В окислительно-восстановительных реакциях сернистый газ обычно проявляет восстановительные свойства:
2S+4O2 + O2 ↔ 2S+6O3 (кат. V2O5)
3S +4O2 + 2KMnO4 + 2H2O = 2MnO2 + K2S+6O4 + 2H2SO4
В реакции с сероводородом проявляет окислительные свойства:
S+4O2 + 2H2S-2 = 3S0 + 2H2O
Слайд 9
Серная кислота, серный ангидрид
(S+6)
Серная кислота, серный ангидрид
(S+6)
Слайд 10
Химические свойства серной кислоты
1) Разбавленная серная кислота проявляет обычные кислотные свойства
H2SO4
Химические свойства серной кислоты
1) Разбавленная серная кислота проявляет обычные кислотные свойства
H2SO4
+ Fe= H2 + FeSO4
H2SO4 + CuO = CuSO4+ H2O
H2SO4 + 2NaOH = Na2SO4+ H2O
H2SO4 + Na2CO3 = Na2SO4+ H2O + CO2
2) Особые свойства концентрированной серной кислоты
H2SO4(конц) – сильный окислитель.
Она взаимодействует со всеми металлами, кроме золота и металлов платиновой группы, по схеме:
Me + H2SO4(конц) = сульфат + вода + соединение серы (SO2, S, H2S)
Cu + 2H2S+6O4 = CuSO4 + 2H2O + S+4O2
3Zn + 4H2S+6O4 = 3ZnSO4 + 4H2O + S0
Чем активнее металл, тем ниже будет степень окисления у атома серы в продукте реакции.
При комнатной температуре концентрированная серная кислота не реагирует с алюминием, железом, хромом и свинцом (пассивирует).
H2SO4 + CuO = CuSO4+ H2O
H2SO4 + 2NaOH = Na2SO4+ H2O
H2SO4 + Na2CO3 = Na2SO4+ H2O + CO2
2) Особые свойства концентрированной серной кислоты
H2SO4(конц) – сильный окислитель.
Она взаимодействует со всеми металлами, кроме золота и металлов платиновой группы, по схеме:
Me + H2SO4(конц) = сульфат + вода + соединение серы (SO2, S, H2S)
Cu + 2H2S+6O4 = CuSO4 + 2H2O + S+4O2
3Zn + 4H2S+6O4 = 3ZnSO4 + 4H2O + S0
Чем активнее металл, тем ниже будет степень окисления у атома серы в продукте реакции.
При комнатной температуре концентрированная серная кислота не реагирует с алюминием, железом, хромом и свинцом (пассивирует).
Следующая -
Исправь ошибки. Игра








 Окислительновосстановительные реакции
Окислительновосстановительные реакции Материаловедение. Основные задачи материаловедения
Материаловедение. Основные задачи материаловедения Растворы электролитов
Растворы электролитов Медь. Химические свойства. Получение меди. Применение
Медь. Химические свойства. Получение меди. Применение Строение атома углерода
Строение атома углерода Обмен углеводов. Углеводы как химические соединения. Функции углеводов
Обмен углеводов. Углеводы как химические соединения. Функции углеводов Зародження періодичної системи елементів Менделєєва
Зародження періодичної системи елементів Менделєєва Gmp – тиісті өндірістік тәжірибе
Gmp – тиісті өндірістік тәжірибе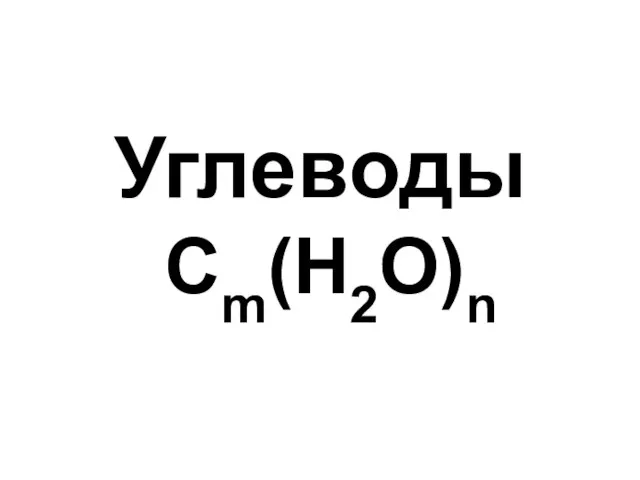 Углеводы. Моносахариды
Углеводы. Моносахариды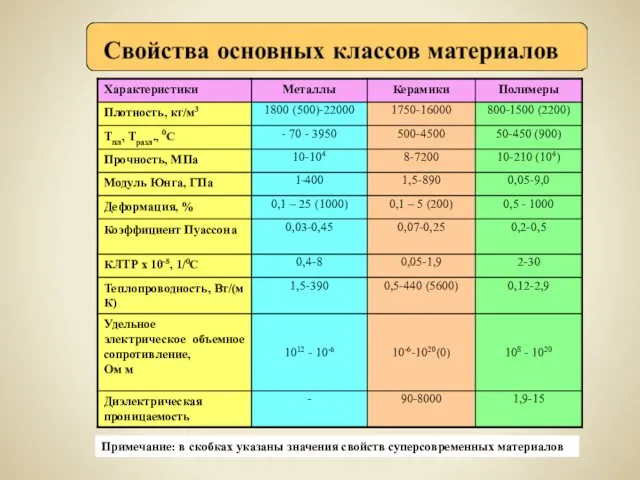 Свойства основных классов материалов
Свойства основных классов материалов Фенолы Простые эфиры
Фенолы Простые эфиры Виконали учениці 33-ї групи Виконали учениці 33-ї групи Українського гуманітарного ліцею КНУ імені Тараса Шевченка Клименко
Виконали учениці 33-ї групи Виконали учениці 33-ї групи Українського гуманітарного ліцею КНУ імені Тараса Шевченка Клименко Вікторина для ерудитів
Вікторина для ерудитів Введение в нефтепереработку. Переработка нефти и газа
Введение в нефтепереработку. Переработка нефти и газа Аминокислоты. Классификация
Аминокислоты. Классификация Химические формулы. 8 класс
Химические формулы. 8 класс Органические производные пятивалентного фосфора. Способы получения
Органические производные пятивалентного фосфора. Способы получения Коррозийное воздействие бензинов а металлы
Коррозийное воздействие бензинов а металлы Металлическая связь
Металлическая связь Биологически важные гетероциклы
Биологически важные гетероциклы История нефтедобычи в России
История нефтедобычи в России Презентация по Химии "Простые вещества - неметаллы" - скачать смотреть
Презентация по Химии "Простые вещества - неметаллы" - скачать смотреть  Химия. Изучение жиров
Химия. Изучение жиров Реакции щелочно-земельных металлов (Группа 2) – Mg, Ca
Реакции щелочно-земельных металлов (Группа 2) – Mg, Ca Современные средства поражений Их краткая характеристика Поражающие факторы
Современные средства поражений Их краткая характеристика Поражающие факторы  В чем секрет любви к мороженому ?
В чем секрет любви к мороженому ? Функциональная роль p53 в регуляции окислительного стресса
Функциональная роль p53 в регуляции окислительного стресса Химия S - элементов
Химия S - элементов