Содержание
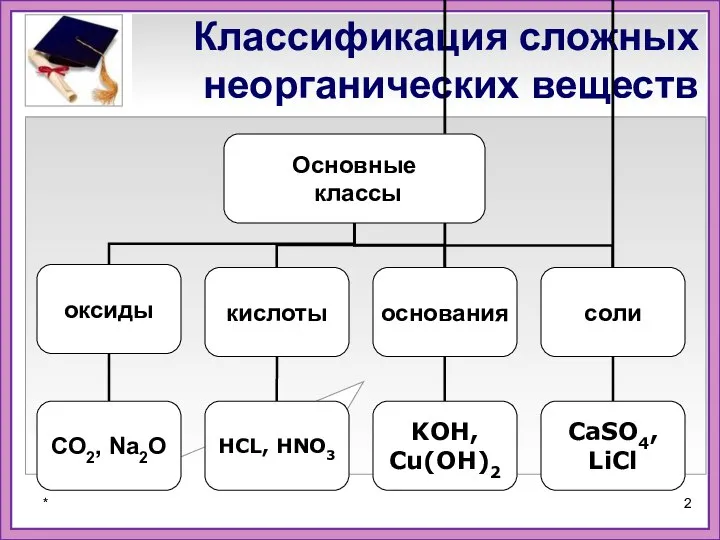
- 2. Классификация сложных неорганических веществ *
- 3. Степень окисления Степень окисления – это условный заряд атома химического элемента в соединении, вычисленный на основе
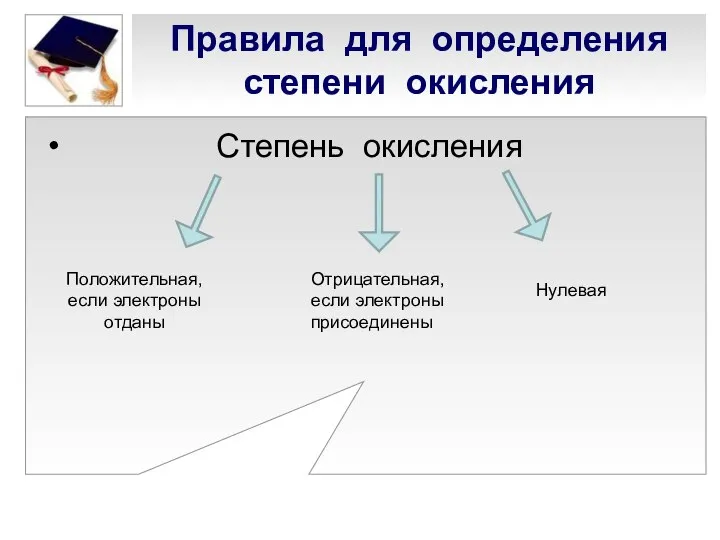
- 4. Степень окисления Правила для определения степени окисления Положительная, если электроны отданы Отрицательная, если электроны присоединены Нулевая
- 5. Нулевая степень окисления Степень окисления простых веществ и свободных атомов всегда равна нулю (0): 0 О2
- 6. Отрицательная степень окисления Степень окисления фтора (F) всегда равна -1; В бинарных соединениях у правого элемента
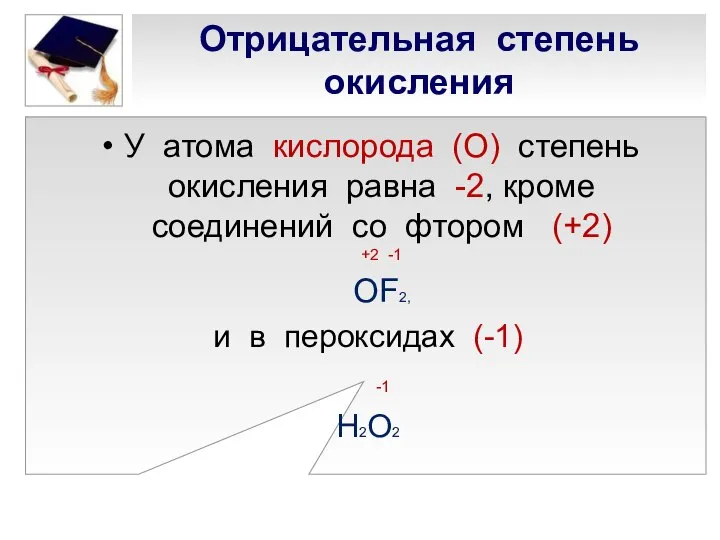
- 7. Отрицательная степень окисления У атома кислорода (О) степень окисления равна -2, кроме соединений со фтором (+2)
- 8. Положительная степень окисления У металлов степень окисления всегда положительна и равна номеру группы (для металлов главных
- 9. Положительная степень окисления У атома водорода степень окисления равна +1 +1 -2 Н2О, Кроме соединений с
- 10. Значения степени окисления Некоторые элементы имеют постоянную степень окисления, а некоторые переменную У элементов с переменной
- 11. Правила определения степени окисления Степень окисления металлов всегда (+) у металлов групп А = № группы
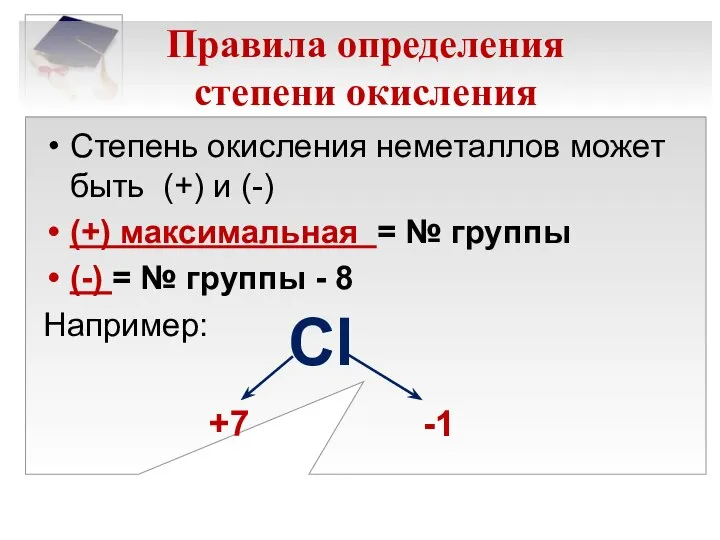
- 12. Правила определения степени окисления Степень окисления неметаллов может быть (+) и (-) (+) максимальная = №
- 13. Алгебраическая сумма степеней окисления в веществе равна нулю
- 14. Алгебраическая сумма степеней окисления в ионе Правило: алгебраическая сумма степеней окисления в сложном ионе равна суммарному
- 15. Бинарные соединения Бинарные соединения – это соединения, состоящие из двух химических элементов. При составлении формул бинарных
- 16. Названия бинарных соединений На первом месте в названии бинарного соединения записывается латинское название элемента с отрицательной
- 17. Названия бинарных соединений. Названия элементов с отрицательной степенью окисления: Cl - хлорид О - оксид Н
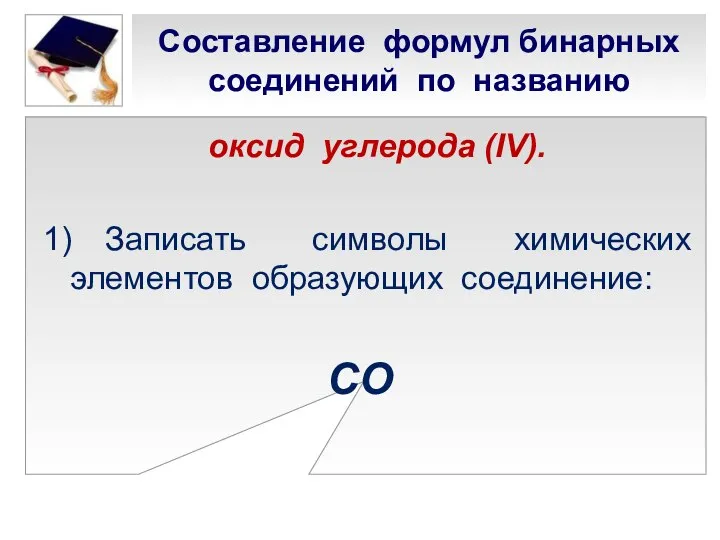
- 18. Составление формул бинарных соединений по названию оксид углерода (IV). 1) Записать символы химических элементов образующих соединение:
- 19. Составление формул бинарных соединений по названию 2) Над атомами химических элементов в соединении проставить их степени
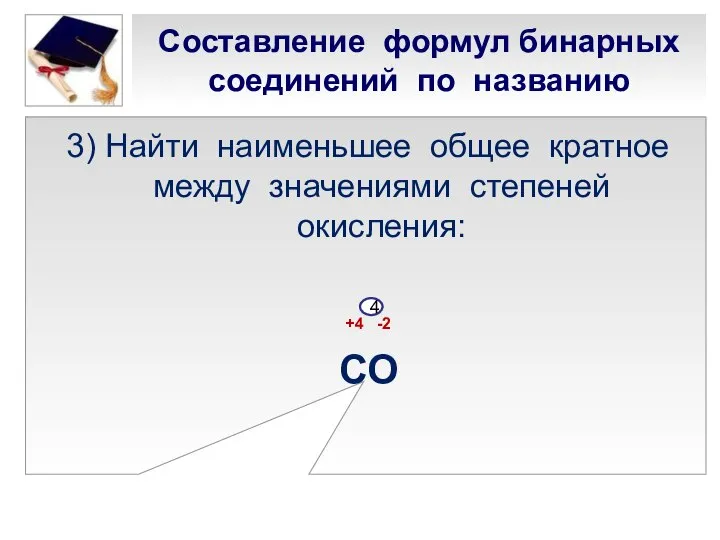
- 20. Составление формул бинарных соединений по названию 3) Найти наименьшее общее кратное между значениями степеней окисления: +4
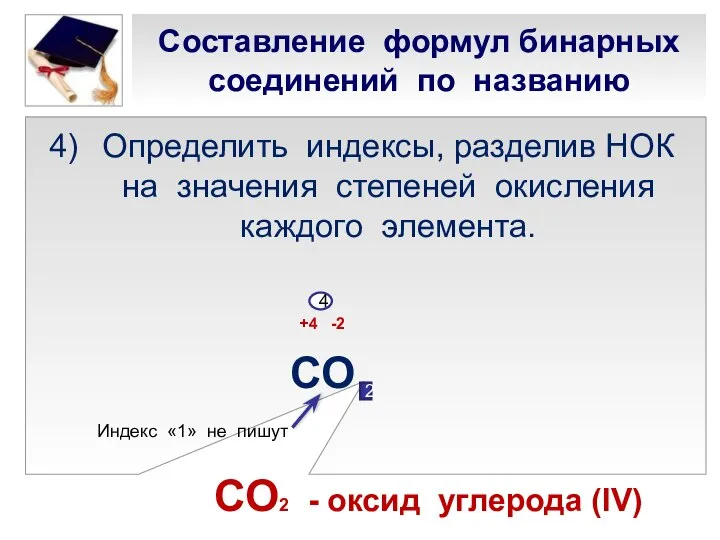
- 21. Составление формул бинарных соединений по названию Определить индексы, разделив НОК на значения степеней окисления каждого элемента.
- 22. Правило креста Правило креста: для составления химических формул по названию вещества надо записать соответствующие знаки химических
- 23. Степень окисления простых веществ равна нулю Например: S0, H02, Cl02, O02, Na0. Максимальная (высшая) степень окисления
- 25. Скачать презентацию















 Многообразие углеводородов. Обобщение
Многообразие углеводородов. Обобщение Заттардың сұйық пен газдағы қозғалуы мысалында диффузия үдерісін зерттеу
Заттардың сұйық пен газдағы қозғалуы мысалында диффузия үдерісін зерттеу Неорганические вещества
Неорганические вещества Язык химии
Язык химии Кислородные соединения азота
Кислородные соединения азота Работы Вильгема Оствальда. Проблема топливных элементов
Работы Вильгема Оствальда. Проблема топливных элементов Спирты
Спирты Нефть. Состав и свойства
Нефть. Состав и свойства Игра - викторина по химии для учащихся 8-х классов
Игра - викторина по химии для учащихся 8-х классов Влияние на скорость ферментативной реакции
Влияние на скорость ферментативной реакции Cинтетичні миючі засоби і їхній вплив на людину
Cинтетичні миючі засоби і їхній вплив на людину  Строение атома. Опыты Резерфорда
Строение атома. Опыты Резерфорда Способы выращивания кристаллов (лекция 3)
Способы выращивания кристаллов (лекция 3) Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Обмен липидов-1
Обмен липидов-1 Спеціалізована Природничо-Математична школа № 16 І-ІІІ ступенів імені М.О.Кириленка Вплив хімічних сполук на довкілля
Спеціалізована Природничо-Математична школа № 16 І-ІІІ ступенів імені М.О.Кириленка Вплив хімічних сполук на довкілля  Нафтопереробна промисловість України
Нафтопереробна промисловість України  Презентация по химии на тему: Бром
Презентация по химии на тему: Бром  Лекция+№+2 (1)
Лекция+№+2 (1) Коррозия металлов и сплавов
Коррозия металлов и сплавов Электроизоляционные материалы. Лаки и класки
Электроизоляционные материалы. Лаки и класки Щелочноземельные металлы
Щелочноземельные металлы Морозостойкая эпоксидная клеевая композиция марки УП-10-04М
Морозостойкая эпоксидная клеевая композиция марки УП-10-04М Тест Проверь себя
Тест Проверь себя Резеңке. Каучук
Резеңке. Каучук Значение периодического закона Д. И. Менделеева. «Периодическому закону не грозит разрушение, а только развитие и надстройки обещ
Значение периодического закона Д. И. Менделеева. «Периодическому закону не грозит разрушение, а только развитие и надстройки обещ Первое начало термодинамики (Закон сохранения и превращения энергии)
Первое начало термодинамики (Закон сохранения и превращения энергии) Перші спроби класифікації хімічних елементів
Перші спроби класифікації хімічних елементів