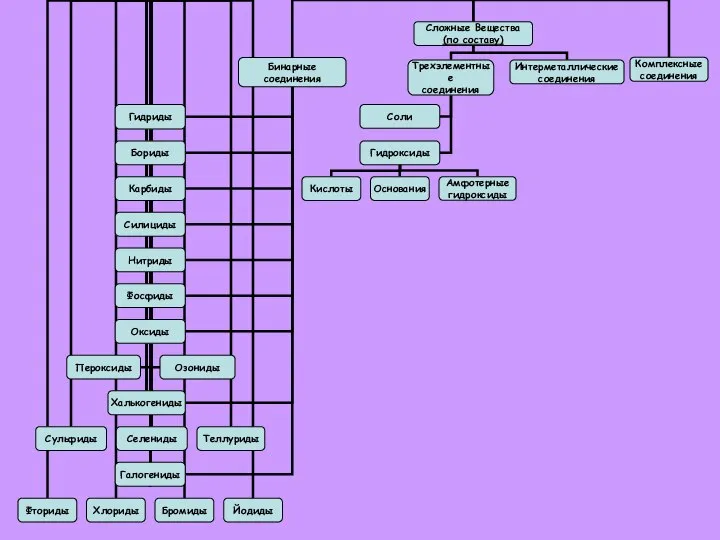
Содержание
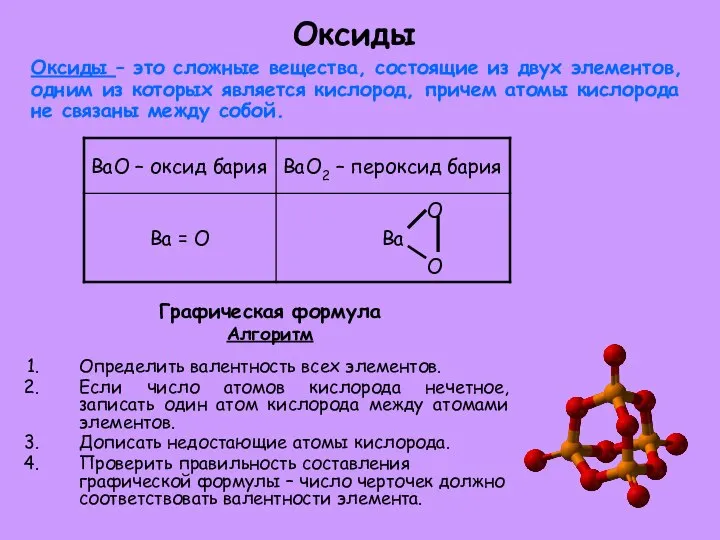
- 5. Оксиды Оксиды – это сложные вещества, состоящие из двух элементов, одним из которых является кислород, причем
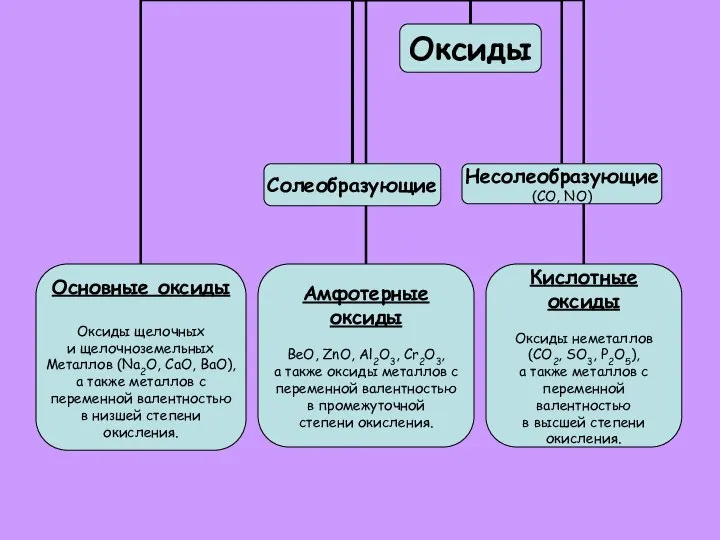
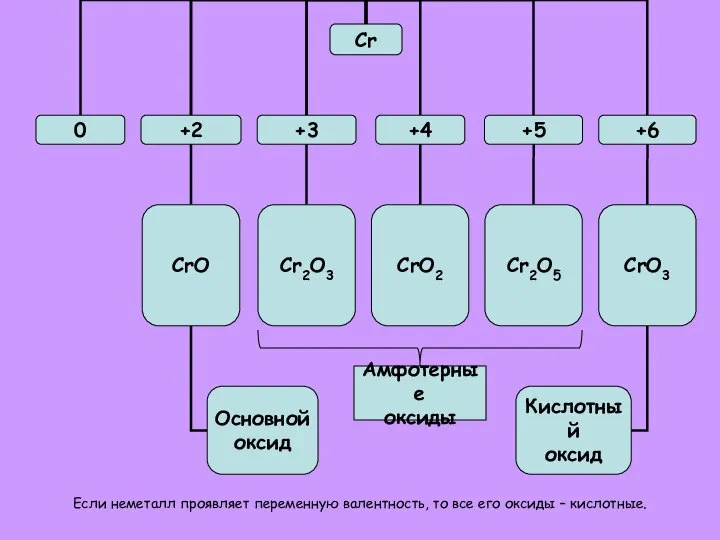
- 8. Если неметалл проявляет переменную валентность, то все его оксиды – кислотные. Амфотерные оксиды
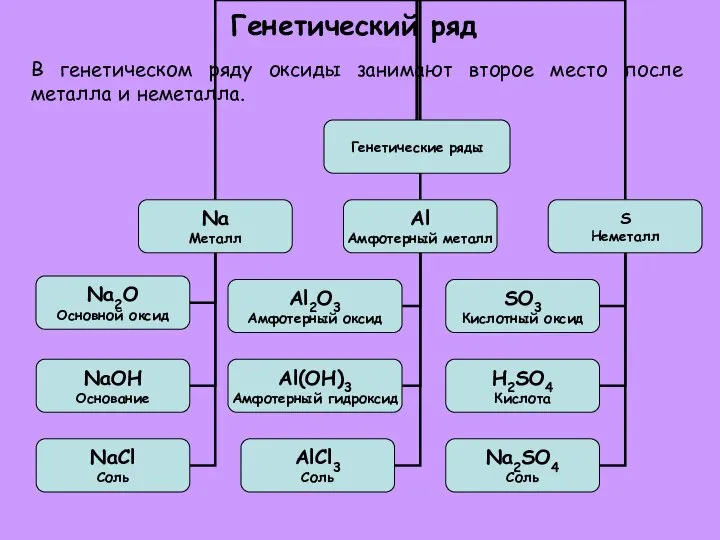
- 9. Генетический ряд В генетическом ряду оксиды занимают второе место после металла и неметалла.
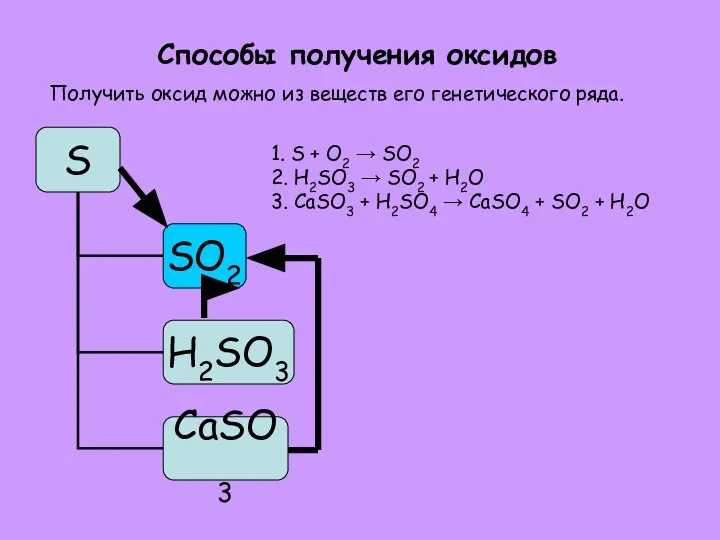
- 10. Способы получения оксидов 1. S + O2 → SO2 2. H2SO3 → SO2 + H2O 3.
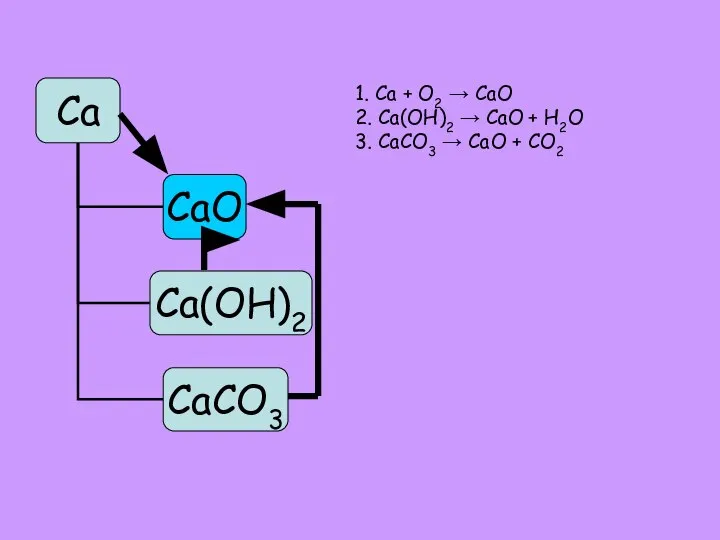
- 11. 1. Ca + O2 → CaO 2. Ca(OH)2 → CaO + H2O 3. CaCO3 → CaO
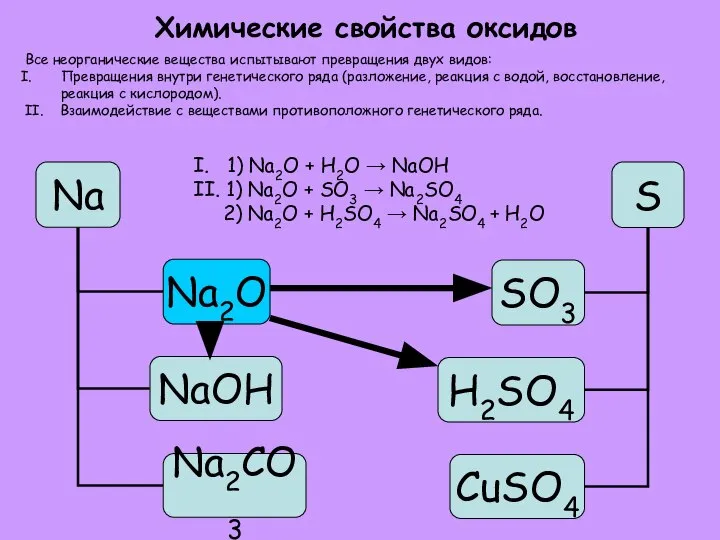
- 12. Химические свойства оксидов I. 1) Na2O + H2O → NaOH II. 1) Na2O + SO3 →
- 13. Амфотерные оксиды Амфотерные оксиды обладают свойствами и кислотных и основных оксидов.
- 14. Кислоты Кислоты – это сложные вещества, диссоциирующие на катионы водорода и анионы кислотного остатка. Графическая формула
- 16. Правила наименования кислот К корню русского названия кислотообразующего элемента добавляется окончание «-ная», «-вая», если степень окисления
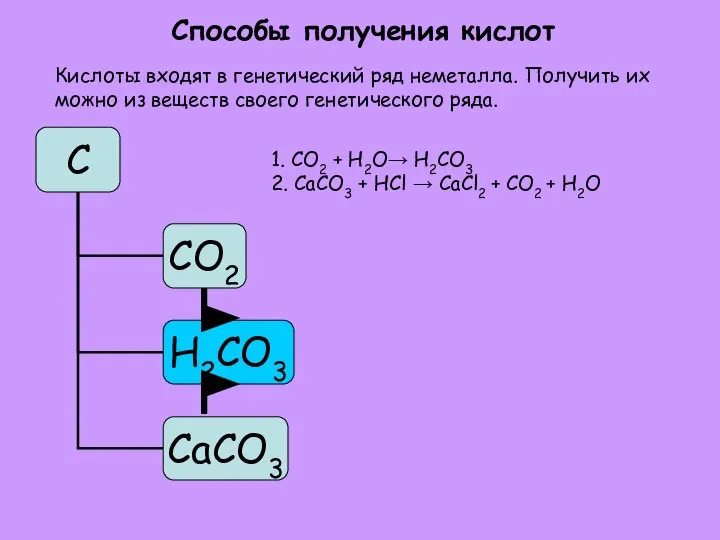
- 18. Способы получения кислот 1. CO2 + H2O→ H2CO3 2. CaCO3 + HCl → CaCl2 + CO2
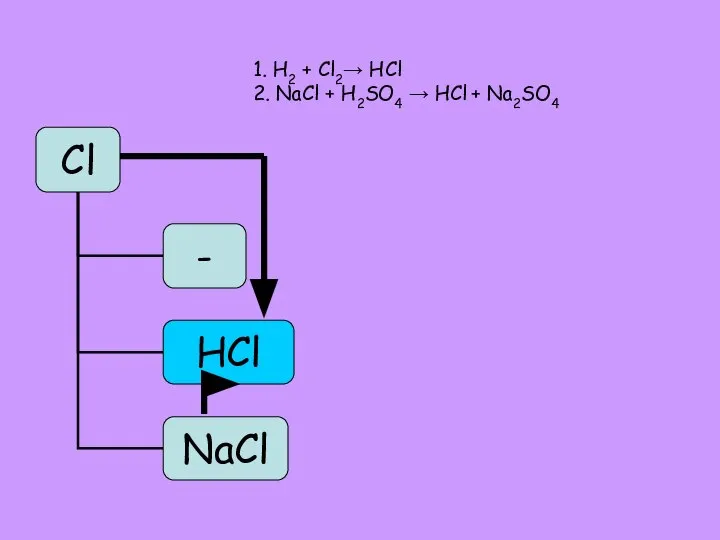
- 19. 1. H2 + Cl2→ HCl 2. NaCl + H2SO4 → HCl + Na2SO4
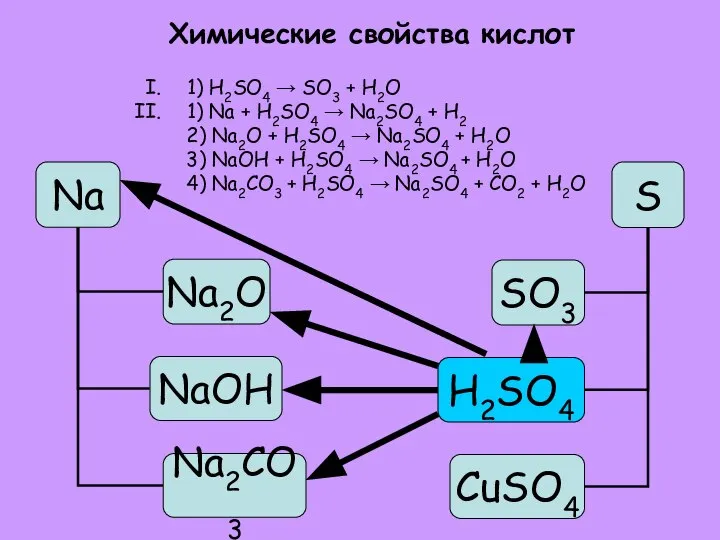
- 20. Химические свойства кислот 1) H2SO4 → SO3 + H2O 1) Na + H2SO4 → Na2SO4 +
- 21. Основания Основания – это сложные вещества, диссоциирующие на катионы металла и гидроксид - ионы. Графическая формула
- 24. Способы получения оснований а) растворимые основания 1. Na + H2O → NaOH + H2 2. Na2O
- 25. б) нерастворимые основания 1. CuSO4 + NaOH → Cu(OH)2↓ + Na2SO4
- 26. Химические свойства оснований а) растворимые основания 1) NaOH → Na2O + H2O 1) NaOH + S
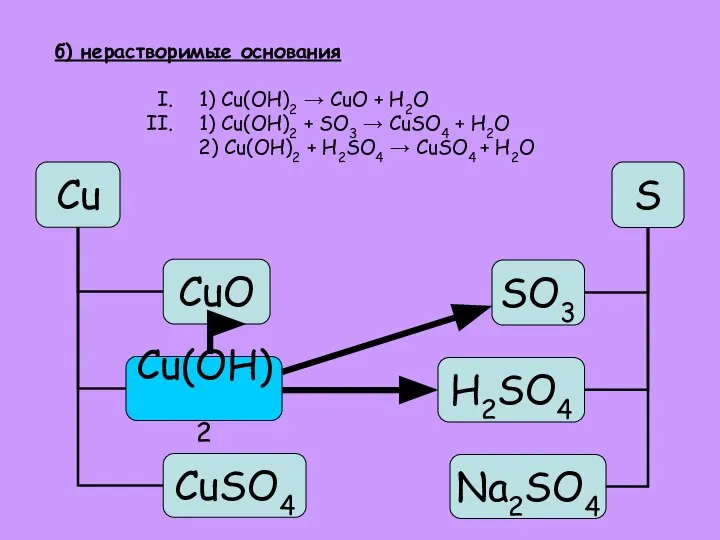
- 27. б) нерастворимые основания 1) Cu(OH)2 → CuO + H2O 1) Cu(OH)2 + SO3 → CuSO4 +
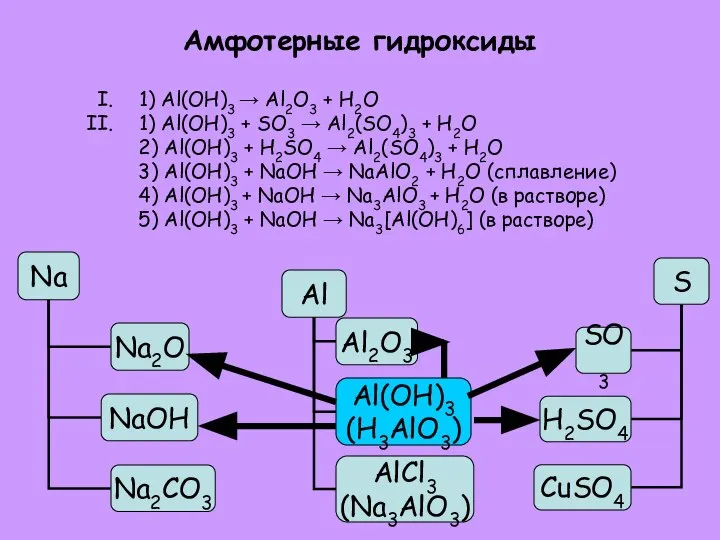
- 28. Амфотерные гидроксиды 1) Al(OH)3 → Al2O3 + H2O 1) Al(OH)3 + SO3 → Al2(SO4)3 + H2O
- 30. Графическая формула Алгоритм Определить валентность всех элементов. Друг под другом записать графические формулы кислотных остатков. Слева
- 31. Средние соли Средние соли – это продукты полного замещения гидроксид – ионов в молекуле основания кислотными
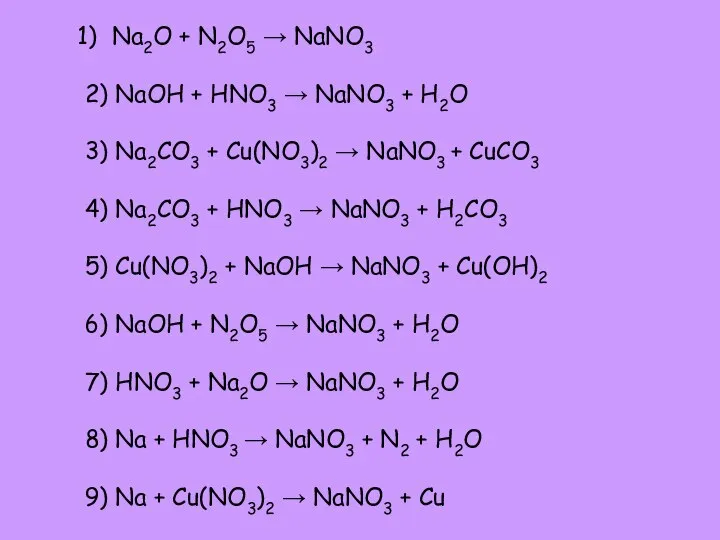
- 33. Способы получения средних солей NaNO3
- 34. Na2O + N2O5 → NaNO3 2) NaOH + HNO3 → NaNO3 + H2O 3) Na2CO3 +
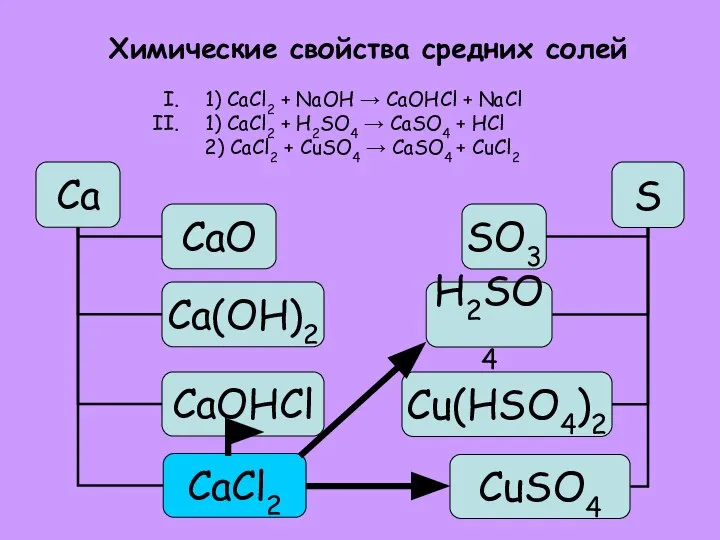
- 35. Химические свойства средних солей 1) CaCl2 + NaOH → CaOHCl + NaCl 1) CaCl2 + H2SO4
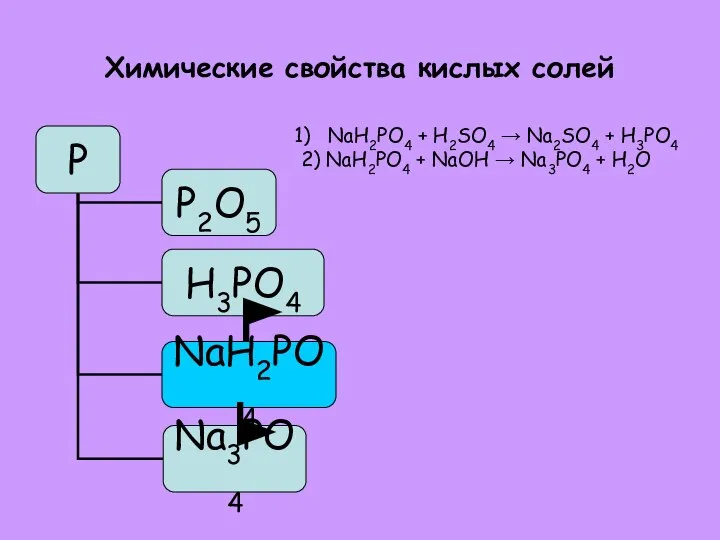
- 36. Кислые соли Кислые соли – это продукты неполного замещения атомов водорода в молекуле кислоты атомами металла.
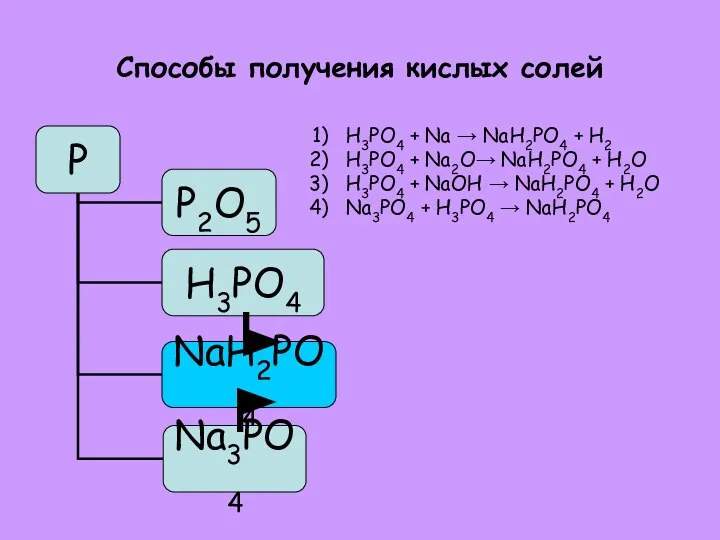
- 38. Способы получения кислых солей H3PO4 + Na → NaH2PO4 + H2 H3PO4 + Na2O→ NaH2PO4 +
- 39. Химические свойства кислых солей NaH2PO4 + H2SO4 → Na2SO4 + H3PO4 2) NaH2PO4 + NaOH →
- 40. Основные соли Основные соли – это продукты неполного замещения гидроксид – ионов в молекуле основания кислотными
- 42. Способы получения основных солей Fe(OH)3 + HCl → FeOHCl2 + H2O FeCl3 + NaOH → FeOHCl2
- 43. Химические свойства основных солей FeOHCl2 + NaOH → Fe(OH)3 + NaCl 2) FeOHCl2 + HCl →
- 45. Скачать презентацию

























 Окислительно-восстановительные процессы. Лекция 8
Окислительно-восстановительные процессы. Лекция 8 Составление уравнений ОВР
Составление уравнений ОВР Агрегатные состояния вещества
Агрегатные состояния вещества Химия в продуктах питания
Химия в продуктах питания Полимерные материалы и изделия. (Лекция 16)
Полимерные материалы и изделия. (Лекция 16) Презентация по Химии "КАРБОНОВЫЕ КИСЛОТЫ-СТРОЕНИЕ И НОМЕНКЛАТУРА" - скачать смотреть бесплатно
Презентация по Химии "КАРБОНОВЫЕ КИСЛОТЫ-СТРОЕНИЕ И НОМЕНКЛАТУРА" - скачать смотреть бесплатно Оксиды. Оксиды металлов и оксиды неметаллов
Оксиды. Оксиды металлов и оксиды неметаллов Алкены - Презентация по Химии_
Алкены - Презентация по Химии_ Катенаны. Ротаксаны (лекция 6)
Катенаны. Ротаксаны (лекция 6) Химия, 8 класс УЧИТЕЛЬ Краснова Оксана Владимировна
Химия, 8 класс УЧИТЕЛЬ Краснова Оксана Владимировна  Презентация по Химии "АЗОТНАЯ КИСЛОТА И ЕЕ СВОЙСТВА" - скачать смотреть бесплатно
Презентация по Химии "АЗОТНАЯ КИСЛОТА И ЕЕ СВОЙСТВА" - скачать смотреть бесплатно Гликогенді және кетогенді аминқышқылдары. Биологиялық рөлі
Гликогенді және кетогенді аминқышқылдары. Биологиялық рөлі Показатель активности водородных ионов. Лабораторная работа №4
Показатель активности водородных ионов. Лабораторная работа №4 Леция 1. Природа сил взаимодействия. Методы исследования комплексообразования:
Леция 1. Природа сил взаимодействия. Методы исследования комплексообразования: Історія відкриття періодичної системи хімічних елементів Д. І. Меделєєва
Історія відкриття періодичної системи хімічних елементів Д. І. Меделєєва Физические явления в химии НЕОРГАНИЧЕСКАЯ ХИМИЯ 8 КЛАСС УЧИТЕЛЬ ХИМИИ: Т.А. КОМАРОВА
Физические явления в химии НЕОРГАНИЧЕСКАЯ ХИМИЯ 8 КЛАСС УЧИТЕЛЬ ХИМИИ: Т.А. КОМАРОВА Химическое равновесие в газах и растворах
Химическое равновесие в газах и растворах Химия элементов VIA группы
Химия элементов VIA группы Физические и химические явления
Физические и химические явления Торжество периодического закона К 175-летию со дня рождения Д. И. Менделеева К 140-летию со дня создания Периодического закона
Торжество периодического закона К 175-летию со дня рождения Д. И. Менделеева К 140-летию со дня создания Периодического закона Электролитическая диссоциация(ЭД). Теория электролитической диссоциации (ТЭД)
Электролитическая диссоциация(ЭД). Теория электролитической диссоциации (ТЭД) Фосфаттардағы байланыс теориясы
Фосфаттардағы байланыс теориясы Ионная химическая связь
Ионная химическая связь Особенности строения, реакционной способности и методы синтеза карбоновых кислот и функциональных производных
Особенности строения, реакционной способности и методы синтеза карбоновых кислот и функциональных производных Откуда ты, химия ?
Откуда ты, химия ? Ненасыщенные углеводороды этиленового ряда
Ненасыщенные углеводороды этиленового ряда Как сохранить жизнь букету
Как сохранить жизнь букету Химиялық реакциялардың типтері
Химиялық реакциялардың типтері