Содержание
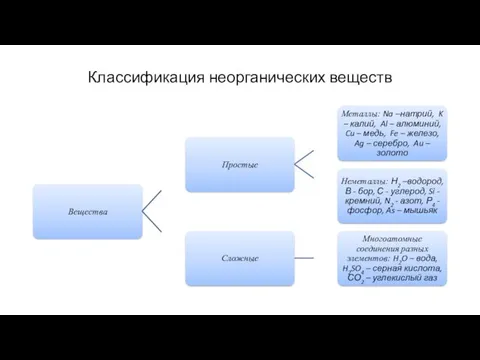
- 2. Классификация неорганических веществ
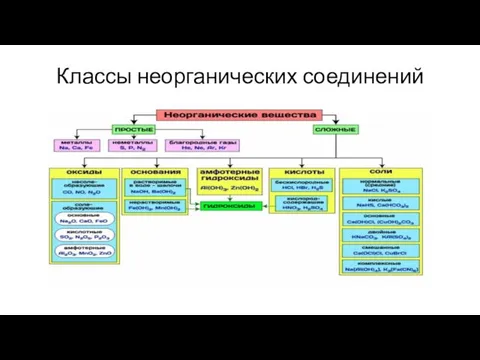
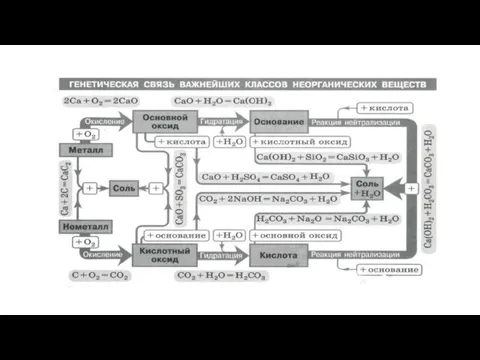
- 3. Классы неорганических соединений
- 4. Оксиды Оксиды – сложные вещества, молекулы которых состоят из атомов двух элементов, один из которых кислород.
- 5. Оксиды Основные оксиды: оксиды металлов +1, +2 (СuO, Ag2O, Fe2O3) СаО + Н2О → Са(ОН)2 –
- 6. СВЯЗЬ ХАРАКТЕРА ОКСИДА С ПОЛОЖЕНИЕМ ЭЛЕМЕНТА В ПЕРИОДИЧЕСКОЙ ТАБЛИЦЕ МЕНДЕЛЕЕВА
- 7. ДРУГИЕ КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ ПЕРОКСИДЫ – О22-, например К2О2, Н2О2, СаО2, ВаО2 Пероксиды сильные окислители, но могут
- 8. Основания Основания – сложные вещества, при диссоциации которых в качестве анионов образуются гидроксид-ионы ОН-. Названия оснований
- 9. Классификация оснований
- 10. Разделение оснований по количеству гидроксогрупп По кислотности (количеству гидроксогрупп) основания бывают: однокислотные (NаОН и др.); поликислотные
- 11. Разделение оснований по растворимости По растворимости различают: растворимые в воде основания или щелочи, образуемые щелочными и
- 12. Щелочи Кристаллы щелочей при растворении в воде полностью диссоциируют, то есть распадаются на положительно заряженные ионы
- 13. Щелочи- изменение окраски индикатора в растворах щелочей Фактически с индикатором взаимодействуют гидроксид-ионы, содержащиеся в растворе любой
- 14. Свойства оснований Все основания взаимодействуют с растворами кислот, образуя соли: Fе(ОН)2 + 2НСl → FеСl2 +
- 15. Кислоты Кислоты - сложные вещества, при диссоциации которых в качестве катионов образуются ионы водорода Н+. Например,
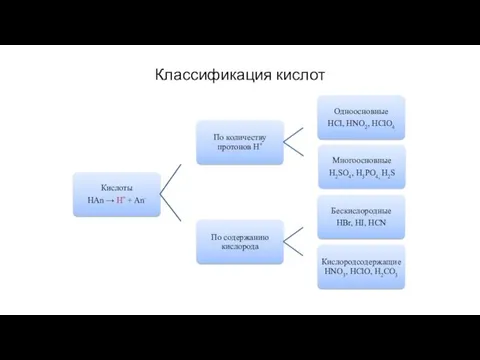
- 16. Классификация кислот
- 17. Разделение кислот по количеству ионов водорода По основности (количеству ионов водорода) кислоты различают на: - одноосновные
- 18. Кислоты По содержанию кислорода кислоты бывают: бескислородные (НСl, НСN, HF, H2S и др.); кислородсодержащие (НNО2, Н2SО3
- 20. Кислотность среды
- 21. Соли Соли – сложные вещества, при диссоциации которых образуются катионы металлов (или аммония NН4+) и анионы
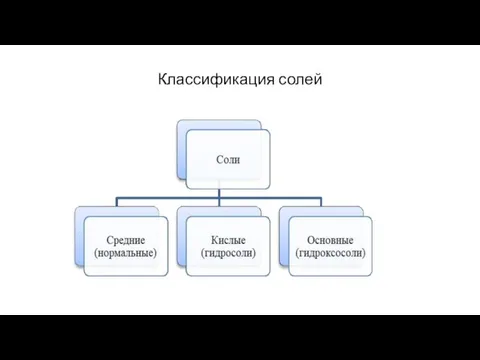
- 22. Классификация солей
- 23. Средние соли Средние соли – продукты полного замещения ионов водорода в кислоте ионами металлов (или аммония)
- 24. Кислые соли Кислые соли – продукты неполного замещения ионов водорода полиосновных кислот ионами металлов (или аммония):
- 25. Основные соли Основные соли – продукты неполного замещения гидроксогрупп поликислотных оснований кислотными остатками: Fе(ОН)3 + НNО3
- 26. Смешанные соли Смешанные соли – образованы двумя металлами и одним кислотным остатком. Например, KA1(SO4)2 – сульфат
- 27. Двойные соли Двойные соли – образованы одним металлом и двумя кислотными остатками. Например, CaClOCl – хлоридгипохлорит
- 29. Кристаллогидраты Среди солей существует очень много кристаллогидратов. Это кристаллические соединения, содержащие воду. У этих соединений определенный
- 30. Примерные вопросы тестов Из предложенного ряда оксидов выбрать кислотные. Из предложенных веществ выбрать то, которое при
- 33. Некоторые свойства неорганических веществ
- 34. Пример задач на практическом занятии
- 36. Взаимодействие кислот с металлами Кислоты взаимодействуют с металлами, стоящими в ряду активности металлов левее водорода. В
- 37. Окисление химических элементов Окисление щелочных металлов 4Li + О2 = 2Li2O оксид лития 2Na + О2
- 39. Взаимодействие основных оксидов с водой
- 40. Взаимодействие кислотных оксидов с водой
- 41. Взаимодействие кислот с основными оксидами
- 42. Некоторые свойства оксидов
- 43. Способы получения солей
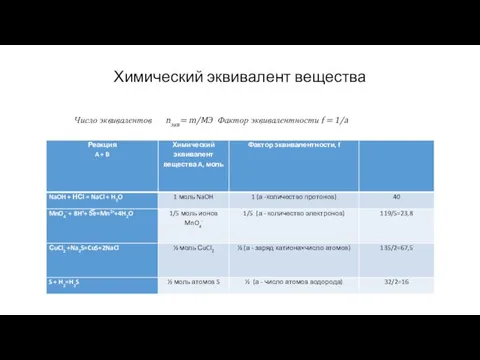
- 44. Химический эквивалент Химический эквивалент Э, моль – это количество вещества, которое может замещать, присоединять, высвобождать или
- 45. Химический эквивалент вещества Число эквивалентов nэкв= m/MЭ Фактор эквивалентности f = 1/а
- 46. Степени окисления
- 47. Степень окисления и валентность
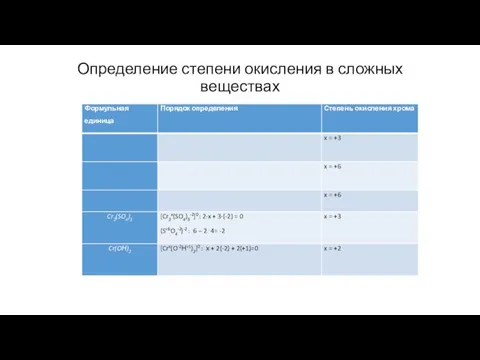
- 48. Определение степени окисления в сложных веществах
- 49. Пример решения задач Определите химический эквивалент хлора в следующих соединениях: НСlО, НСlО4. H+ + Clx +
- 50. Пример решения задач Определите химические эквиваленты и молярные массы эквивалентов следующих веществ: Cl2O, Mg(OH)2, H3BO3, Ca3(PO4)2.
- 51. Пример решения задач Определите число молей и число эквивалентов в 90 л оксида азота (II) NО
- 52. Пример решения задач Определите число молей и число эквивалентов в 85 г кремниевой кислоты H2SiO3. М=
- 53. Пример решения задач Определите массу 5,8 эквивалентов силиката кальция СаSiО3. Решение. М= 40+28+16х3=116 г. Э=1/2; Мэ=
- 54. Пример решения задач Определите объем 9,3 эквивалентов аммиака NН3 (н.у.). Vэ=22,4/3( по водороду)=7,5л 9,3 эквивалентных объема
- 56. Пример решения задач Рассчитайте объем водорода (н.у.), необходимый для восстановления 100 г оксида, массовая доля металла
- 57. Пример решения задач Рассчитайте молярную массу эквивалента металла и определите какой это металл, если при взаимодействии
- 58. Пример решения задач Рассчитать молярную массу эквивалента металла, если 1 г его при окислении образует 1,35
- 60. Скачать презентацию


















































 Органические и неорганические вещества. Нуклеиновые кислоты
Органические и неорганические вещества. Нуклеиновые кислоты ОМЕГА 3 и ОМЕГА 6 полиненасыщенные жирные кислоты (ПНЖК) Все более популярными в ветеринарии становятся ОМЕГА 3 и ОМЕГА 6 полиненасы
ОМЕГА 3 и ОМЕГА 6 полиненасыщенные жирные кислоты (ПНЖК) Все более популярными в ветеринарии становятся ОМЕГА 3 и ОМЕГА 6 полиненасы Тест: Азот
Тест: Азот Витамины и их производные-коферменты ферментов
Витамины и их производные-коферменты ферментов Получение гидроксида никеля (II)
Получение гидроксида никеля (II) Розчини електролітів
Розчини електролітів Вода – растворитель. Растворы. Значение воды
Вода – растворитель. Растворы. Значение воды Використання кислот
Використання кислот Гелий
Гелий Индол. Методы синтеза. Химические свойства. Биологически активные производные. (Лекция 4)
Индол. Методы синтеза. Химические свойства. Биологически активные производные. (Лекция 4) Карбон қышқылдары
Карбон қышқылдары Вступ в гетерогенний катализ. Загальні положення каталізу
Вступ в гетерогенний катализ. Загальні положення каталізу Синтез и свойства кукурбитурилов
Синтез и свойства кукурбитурилов Жиры. 9 класс
Жиры. 9 класс ОКСИДЫ АЗОТА.
ОКСИДЫ АЗОТА.  ВПР Окружающий мир 4 класс
ВПР Окружающий мир 4 класс  Урок по теме: «Жиры. Техническая переработка жиров» Пермякова Ирина Александровна Учитель химии ГБОУ СОШ № 982 г. Москва Индиф
Урок по теме: «Жиры. Техническая переработка жиров» Пермякова Ирина Александровна Учитель химии ГБОУ СОШ № 982 г. Москва Индиф Условия хранения и подготовка скоропортящихся грузов к перевозкам
Условия хранения и подготовка скоропортящихся грузов к перевозкам Инертные газы
Инертные газы Агрегатные состояния вещества
Агрегатные состояния вещества Нанопористые материалы
Нанопористые материалы Предельные углеводороды. Химические свойства. 10 класс
Предельные углеводороды. Химические свойства. 10 класс Природные и синтетические красители и ароматизаторы
Природные и синтетические красители и ароматизаторы Химические свойства фурана, пиррола, тиофена. Биологически активные производные ряда фурана, пиррола, тиофена. (Лекция 3)
Химические свойства фурана, пиррола, тиофена. Биологически активные производные ряда фурана, пиррола, тиофена. (Лекция 3) МОУ «Каратунская СОШ с углубленным изучением отдельных предметов» Выполнила : учитель химии второй квалификационной категор
МОУ «Каратунская СОШ с углубленным изучением отдельных предметов» Выполнила : учитель химии второй квалификационной категор Элективный курс "Решение задач по химии повышенного уровня сложности"
Элективный курс "Решение задач по химии повышенного уровня сложности" Сложные эфиры R-COOR'
Сложные эфиры R-COOR' Оценка опасности взрыва горючих газов
Оценка опасности взрыва горючих газов