Содержание
- 2. Существует физическая величина, прямо пропорциональная числу частиц, составляющих данное вещество и входящих во взятую порцию этого
- 3. Количество вещества — физическая величина, характеризующая количество однотипных структурных единиц, которые содержатся в веществе. Под структурными
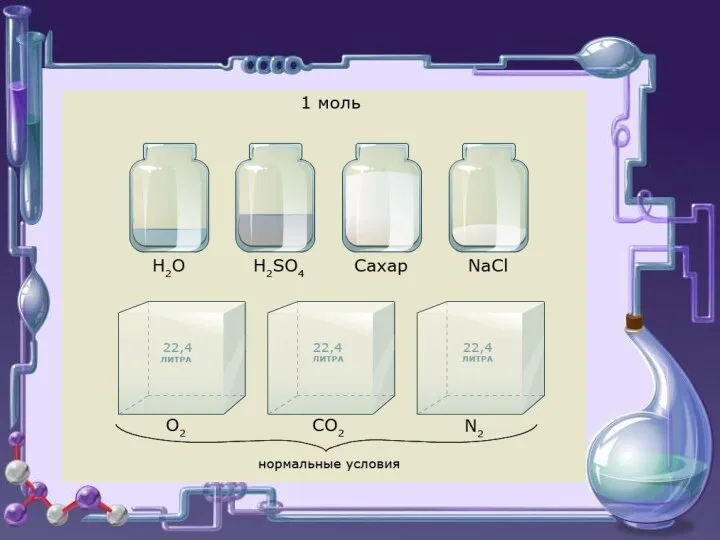
- 4. Молярная масса -это масса одного моля вещества. М=[г/моль] ( молярная масса численно равна молекулярной массе) ,
- 5. о Закон объемных отношений Измеряя объемы, и объемы газов, в результате реакции Ж.Л. Гей-Люссак открыл закон
- 6. Например
- 7. Закон объёмных отношений позволил итальянскому учёному А. Авогадро предположить, что молекулы простых газов состоят из двух
- 8. Определите молярную массу газа, если его относительная плотность по воздуху равна 5,105 Решение: D газа по
- 9. о о А. Авогадро 1811 Итальянский ученый Амадео Авогадро сформулировал закон (для газов) : в равных
- 10. Следствия (для газов) Отношение массы определённого объёма одного газа к массе такого же объёма другого газа,
- 12. Уравнение связи Где n- количество вещества (моль)
- 14. Задачи (закрепление) Найдите число молекул в 2 молях водорода. Найдите массу 3 моль углекислого газа (СО2
- 15. 1.Определите молярную массу газа, если его относительная плотность по воздуху равна 2,207. 2. Определите относительную плотность
- 17. Скачать презентацию


![Молярная масса -это масса одного моля вещества. М=[г/моль] ( молярная масса](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/693500/slide-3.jpg)










 Презентация по Химии "Закон сохранения массы вещества" - скачать смотреть
Презентация по Химии "Закон сохранения массы вещества" - скачать смотреть  Обмен нуклеотидов
Обмен нуклеотидов Презентация по Химии "Методическая тема учителя химии и биологии" - скачать смотреть
Презентация по Химии "Методическая тема учителя химии и биологии" - скачать смотреть  Бром және оның қасиеттері
Бром және оның қасиеттері Игра по химии Разработала учитель химии МОУ «Яльчикская СОШ» Левая В.Н.
Игра по химии Разработала учитель химии МОУ «Яльчикская СОШ» Левая В.Н. Определение химического элемента на основании расчетов по химическим реакциям
Определение химического элемента на основании расчетов по химическим реакциям Способы количественного определения белка. (Лекция 10)
Способы количественного определения белка. (Лекция 10) Алканы: изомерия и номенклатура
Алканы: изомерия и номенклатура Важнейшие минералы
Важнейшие минералы Экспресс-методы решения задач по химии
Экспресс-методы решения задач по химии Адсорбционные равновесия и процессы на подвижных и неподвижных границах раздела
Адсорбционные равновесия и процессы на подвижных и неподвижных границах раздела Экскурсия по химическому факультету
Экскурсия по химическому факультету 11 класс Урок по теме Почему протекают химические реакции Составитель презентации – учитель химии МОУ СОШ им. А.С. Попова Иванова
11 класс Урок по теме Почему протекают химические реакции Составитель презентации – учитель химии МОУ СОШ им. А.С. Попова Иванова  Общая характеристика металлов IА группы ПСХЭ Д.И. Менделеева
Общая характеристика металлов IА группы ПСХЭ Д.И. Менделеева Зеленая химия и проблемы устойчивого развития Член-корреспондент РАН Н.П.Тарасова РХТУ им.Д.И.Менделеева Институт химии и про
Зеленая химия и проблемы устойчивого развития Член-корреспондент РАН Н.П.Тарасова РХТУ им.Д.И.Менделеева Институт химии и про Простые и сложные вещества. Металлы и неметаллы. Бинарные соединения
Простые и сложные вещества. Металлы и неметаллы. Бинарные соединения Точечные дефекты в кристаллах
Точечные дефекты в кристаллах Классификация и краткие характеристики основных групп токсикантов
Классификация и краткие характеристики основных групп токсикантов Железоуглеродистые сплавы
Железоуглеродистые сплавы Основные свойства кристаллов
Основные свойства кристаллов Неорганические полимеры
Неорганические полимеры ТИР применительно к кислотно-основным взаимодействиям
ТИР применительно к кислотно-основным взаимодействиям Растворы. Часть 1
Растворы. Часть 1 Содержание ртути и её соединений в воздухе при использовании осветительных ламп
Содержание ртути и её соединений в воздухе при использовании осветительных ламп Зеленая химия и проблемы устойчивого развития
Зеленая химия и проблемы устойчивого развития Алкілування ізобутану бутенами
Алкілування ізобутану бутенами Уравнение Г-Х-К для мембранного потенциала
Уравнение Г-Х-К для мембранного потенциала Нечаев 18
Нечаев 18