Содержание
- 2. Комплексное соединение - сложное соединение, образующееся при взаимодействии более простых структурных частиц (атомов, ионов или молекул),
- 3. [Cu(NH3)4]SO4 Na[Al(OH)4] NaOH Al(OH)3
- 4. Комплексными соединениями, или просто комплексами, называют соединения, имеющие в своем составе комплексные ионы.
- 5. [Co(NH3)6]3+ - комплекс [Co(NH3)6]Cl3 – комплексное соединение (соль). [Fe(CO)5] – комплекс и комплексное соединение Комплекс означает
- 6. Основные положения координационной теории Комплексообразователь (центральный катион) - катион металла, который обладает вакантными орбиталями. Катионы: металлов
- 7. Вокруг комплексообразователя расположены лиганды – частицы, обладающие неподеленными электронными парами. Основные положения координационной теории 2. Молекулы:
- 8. Основные положения координационной теории Координационное число – количество лигандов, которые может присоединять комплексообразователь. 3. Координационное число
- 9. Основные положения координационной теории Комплексообразователь и лиганды составляют внутреннюю сферу комплекса. 4. [Cu(NH3)4]+2
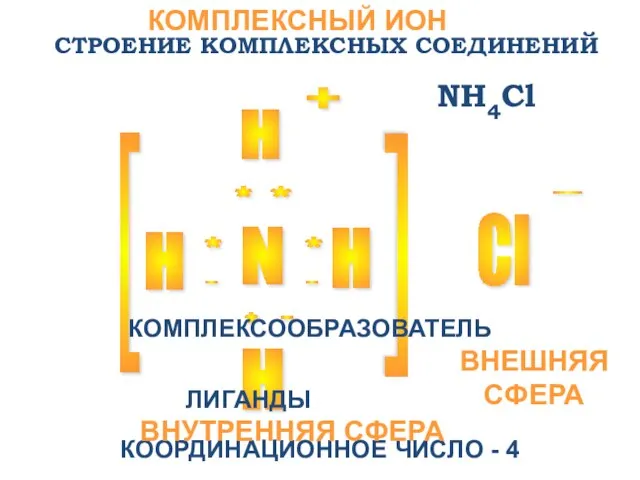
- 10. СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ N H H H Cl + - [ [ * * * *
- 11. [N-3H+14]Cl-1 КОМПЛЕКСНЫЙ ИОН [NH4]+ ВНУТРЕННЯЯ СФЕРА: КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3 ЛИГАНДЫ H+ ВНЕШНЯЯ СФЕРА АНИОН Cl-
- 12. Строение комплексного соединения K3 [Fe(CN)6] Ион-комплексообразователь (центральный атом) Лиганды Координационное число Внутренняя сфера Внешняя сфера
- 13. Лиганд – ион или нейтральная молекула, которые связаны с центральным атомом и могут существовать независимо от
- 14. Примеры лигандов Анионы бескислородных кислот F-, Cl-, Br-, I- (фторо-лиганд и т.д.) Пример: K2[HgI4] – тетраиодомеркурат(II)
- 15. Донорный атом O OH- - гидроксо-лиганд O2- - оксо-лиганд O22- - пероксо-лиганд K2[Zn(OH)4] – тетрагидроксоцинкат(II) калия
- 16. (OH)- 4 [Zn+x Na+ (+1) + x + (-1) ] 2 ·2 ·4 = 0 x
- 17. РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ: Na3[AlF6] Ответ: Na+3[Al+3F-6] K[MgCl3] Na[Al(OH)4] Na4[Fe(CN)6] Na3[Al(OH)6] [Cu(NH3)4]Cl2 Ответ: Na+[Al+3(OH)-4] Ответ:
- 18. Строение комплексных соединений Координационные соединения образованы металлами побочных подгрупп, имеющими, как правило, незавершенный d - уровень.
- 19. Строение комплексных соединений Для образования прочных связей внутри комплексного соединения энергетически выгодно освободить две d-орбитали спариванием
- 20. Классификация комплексных соединений по заряду комплекса по виду лигандов по составу внешней сферы
- 21. Классификация По заряду комплекса [Cr(H2O)4]3+Cl3 [PtCl4(NH3)2] K2[PtCl6]2- [Cu(NH3)4]2+[PtCl4]2-
- 22. Классификация По составу внешней сферы H2[PtCl6] Na3[AlF6] [Pt(NH3)2Cl2] [Ag(NH3)2]OH
- 23. Классификация По виду лигандов [Fe(H2O)6]SO4 K[Au(CN)4] [Zn(NH3)4]Cl2 [CoCl(NH3)3(H2O)2](NO3)2
- 24. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ 2- 4- 3- 5- 6- ди- три- тетра- пента- гекса- ЧИСЛИТЕЛЬНЫЕ: НАЗВАНИЯ ЛИГАНДОВ:
- 25. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ НАЗВАНИЯ АНИОНОВ: Fe - феррат Cu - купрат Ag - аргентат Au -
- 26. тетра гидроксо цинкат НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na+2 4] (OH)- [Zn+2 натрия [Cr+3 (H2O)0 6] Cl-3 хлорид
- 27. НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na3[AlF6] Na[Al(OH)4] K4[Fe(CN)6] Гексафтороалюминат натрия Тетрагидроксоалюминат натрия Гексационоферрат (II) калия
- 28. НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Cu(NH3)4]SO4 Сульфат тетраамминмеди (II) [Ag(NH3)2]Cl Хлорид диамминсеребра Хлорид гексааквахрома (III) [Cr(H2O)6]Cl3
- 29. Ответ: K2[PtCl6] Гексахлороплатинат (IV) калия Нитрат хлоронитротетраамминкобальта (III) Гексагидроксохромат (III) натрия СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВ Ответ: [Co(NH3)4(NO3)Cl]NO3
- 30. ПОЛУЧЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Лабораторный опыт. Получение тетрагидроксоалюмината натрия AlCl3+3NaOH = Al(OH)3↓+3NaCl Al(OH)3 + NaOH = Na[Al(OH)4]
- 31. Химические свойства комплексных соединений 1. В растворе комплексные соединения ведут себя как сильные электролиты, т.е. полностью
- 32. ХИМИЧЕСКИЕ СВОЙСТВА 2. Реакции по внешней сфере FeCl3+K4[Fe(CN)6]→KFe[Fe(CN)6]↓+3KCl [Cu(NH3)4]SO4+BaCl2→ →[Cu(NH3)4]Cl2+BaSO4↓
- 33. ХИМИЧЕСКИЕ СВОЙСТВА 3. Реакции с участием лигандов [Cu(NH3)4]SO4+4HCl→4NH4Cl+CuSO4 4. Реакции по центральному иону Обменные: [Ag(NH3)2]Cl +
- 34. 5. Нагревание (термолиз) всех аммиакатов приводит к их разложению, например: [Cu(NH3) 4]SO4 = CuSO4 + 4NH3
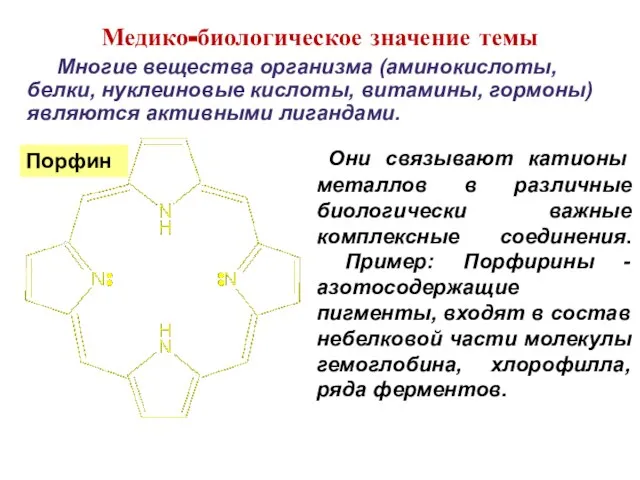
- 35. Они связывают катионы металлов в различные биологически важные комплексные соединения. Пример: Порфирины - азотосодержащие пигменты, входят
- 36. Хлорофилл Медико-биологическое значение темы
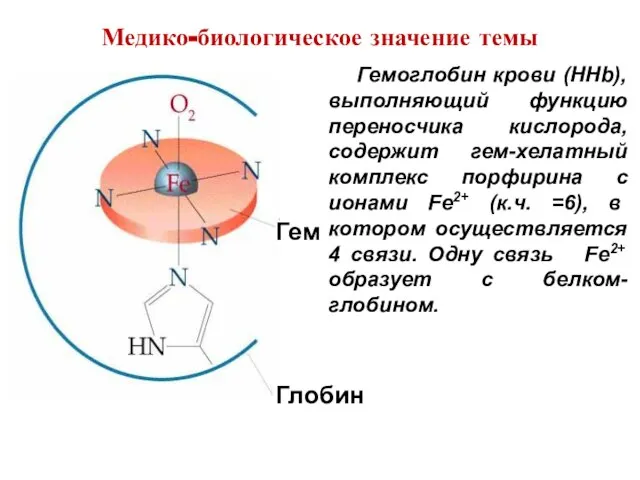
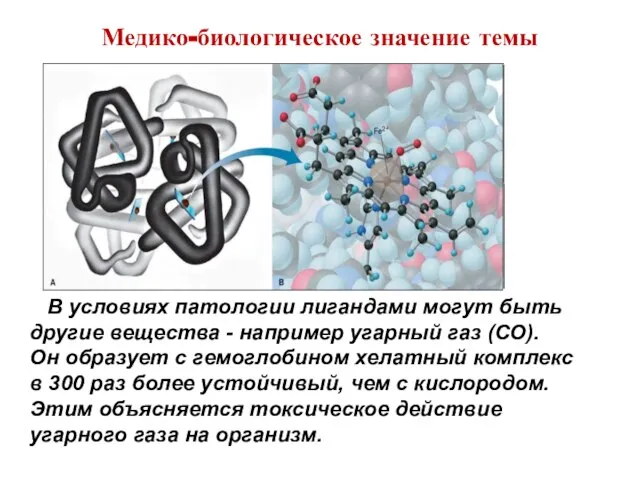
- 37. Гемоглобин крови (HHb), выполняющий функцию переносчика кислорода, содержит гем-хелатный комплекс порфирина с ионами Fe2+ (к.ч. =6),
- 38. В легких, где парциальное давление O2 высоко, он присоединяется к Fe(II) на шестую координационную связь, а
- 39. Медико-биологическое значение темы В условиях патологии лигандами могут быть другие вещества - например угарный газ (CO).
- 40. B12 (Co[C62H88N13O14P])CN B12 - это хелат Co3+ c порфирином Медико-биологическое значение темы
- 41. Медико-биологическое значение темы Цитохром с в своей структуре содержит гем, является компонентом дыхательной цепи митохондрий. Металлоферменты
- 42. Гормон инсулин - хелат Zn2+ c белком. Медико-биологическое значение темы
- 43. Написать уравнения реакций, при помощи которых можно осуществить превращения:
- 44. Лиганды могут присоединяться к комплексообразователю посредством одного или нескольких атомов, т.е. лиганды обладают координационной емкостью -
- 45. Полидентатные лиганды присоединяются к комплексообразователю посредством нескольких атомов. Например: функциональные органические соединения. Большое практическое значение имеют
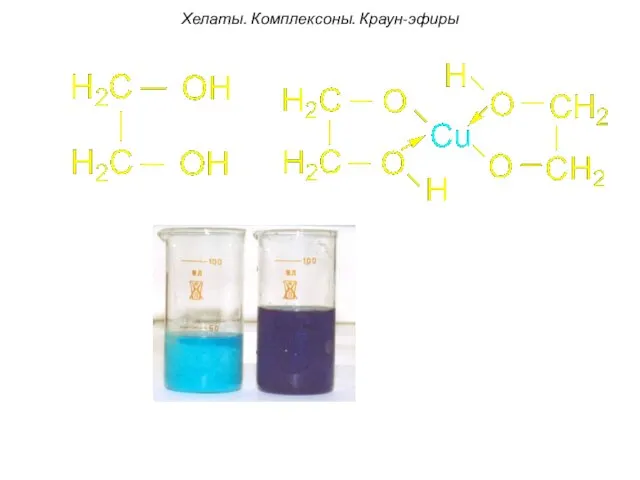
- 46. Хелаты. Комплексоны. Краун-эфиры Н-р, комплексон -I: содержит два атома азота. За счет электронных пар этих атомов
- 47. [Pt2+(Еn)2]2+ этилендиаминплатина (II) Хелаты. Комплексоны. Краун-эфиры
- 48. [Co3+(Еn)3]3+ этилендиаминкобальт(II) Хелаты. Комплексоны. Краун-эфиры
- 49. Хелаты. Комплексоны. Краун-эфиры Для удобства координации молекулы полидентатных лигандов сворачиваются в циклы. В таких комплексах комплексообразователь
- 50. Хелаты. Комплексоны. Краун-эфиры
- 51. Хелаты. Комплексоны. Краун-эфиры +2 хелат Диэтилендиаминмедь(II)
- 52. Хелаты. Комплексоны. Краун-эфиры Обычно хелаты гораздо устойчивее комплексных соединений, содержащих монодентатные лиганды, т.к. комплексообразователь связан с
- 53. Хелаты. Комплексоны. Краун-эфиры
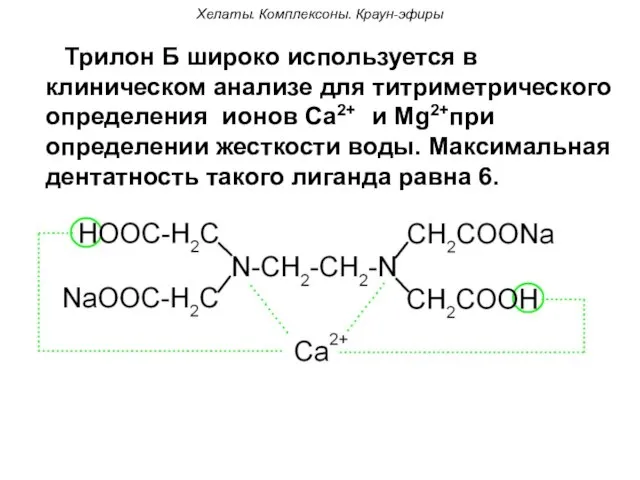
- 54. Хелаты. Комплексоны. Краун-эфиры Трилон Б широко используется в клиническом анализе для титриметрического определения ионов Са2+ и
- 55. Хелаты. Комплексоны. Краун-эфиры Особый тип полидентатных лигандов представляет собой циклические эфиры или краун-эфиры (от анг. crown
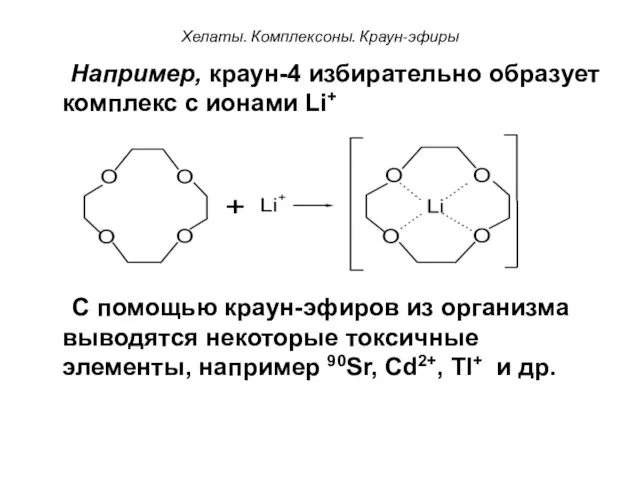
- 56. Хелаты. Комплексоны. Краун-эфиры Например, краун-4 избирательно образует комплекс с ионами Li+ + С помощью краун-эфиров из
- 58. Скачать презентацию

![[Cu(NH3)4]SO4 Na[Al(OH)4] NaOH Al(OH)3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/565230/slide-2.jpg)

![[Co(NH3)6]3+ - комплекс [Co(NH3)6]Cl3 – комплексное соединение (соль). [Fe(CO)5] – комплекс](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/565230/slide-4.jpg)



![Основные положения координационной теории Комплексообразователь и лиганды составляют внутреннюю сферу комплекса. 4. [Cu(NH3)4]+2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/565230/slide-8.jpg)
![[N-3H+14]Cl-1 КОМПЛЕКСНЫЙ ИОН [NH4]+ ВНУТРЕННЯЯ СФЕРА: КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3 ЛИГАНДЫ H+ ВНЕШНЯЯ СФЕРА АНИОН Cl-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/565230/slide-10.jpg)
![Строение комплексного соединения K3 [Fe(CN)6] Ион-комплексообразователь (центральный атом) Лиганды Координационное число Внутренняя сфера Внешняя сфера](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/565230/slide-11.jpg)



![(OH)- 4 [Zn+x Na+ (+1) + x + (-1) ] 2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/565230/slide-15.jpg)
![РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ: Na3[AlF6] Ответ: Na+3[Al+3F-6] K[MgCl3] Na[Al(OH)4] Na4[Fe(CN)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/565230/slide-16.jpg)


![Классификация По заряду комплекса [Cr(H2O)4]3+Cl3 [PtCl4(NH3)2] K2[PtCl6]2- [Cu(NH3)4]2+[PtCl4]2-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/565230/slide-20.jpg)
![Классификация По составу внешней сферы H2[PtCl6] Na3[AlF6] [Pt(NH3)2Cl2] [Ag(NH3)2]OH](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/565230/slide-21.jpg)
![Классификация По виду лигандов [Fe(H2O)6]SO4 K[Au(CN)4] [Zn(NH3)4]Cl2 [CoCl(NH3)3(H2O)2](NO3)2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/565230/slide-22.jpg)


![тетра гидроксо цинкат НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na+2 4] (OH)- [Zn+2 натрия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/565230/slide-25.jpg)
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na3[AlF6] Na[Al(OH)4] K4[Fe(CN)6] Гексафтороалюминат натрия Тетрагидроксоалюминат натрия Гексационоферрат (II) калия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/565230/slide-26.jpg)
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Cu(NH3)4]SO4 Сульфат тетраамминмеди (II) [Ag(NH3)2]Cl Хлорид диамминсеребра Хлорид гексааквахрома (III) [Cr(H2O)6]Cl3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/565230/slide-27.jpg)
![Ответ: K2[PtCl6] Гексахлороплатинат (IV) калия Нитрат хлоронитротетраамминкобальта (III) Гексагидроксохромат (III) натрия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/565230/slide-28.jpg)


![ХИМИЧЕСКИЕ СВОЙСТВА 2. Реакции по внешней сфере FeCl3+K4[Fe(CN)6]→KFe[Fe(CN)6]↓+3KCl [Cu(NH3)4]SO4+BaCl2→ →[Cu(NH3)4]Cl2+BaSO4↓](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/565230/slide-31.jpg)
![ХИМИЧЕСКИЕ СВОЙСТВА 3. Реакции с участием лигандов [Cu(NH3)4]SO4+4HCl→4NH4Cl+CuSO4 4. Реакции по](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/565230/slide-32.jpg)



![B12 (Co[C62H88N13O14P])CN B12 - это хелат Co3+ c порфирином Медико-биологическое значение темы](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/565230/slide-39.jpg)






![[Pt2+(Еn)2]2+ этилендиаминплатина (II) Хелаты. Комплексоны. Краун-эфиры](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/565230/slide-46.jpg)
![[Co3+(Еn)3]3+ этилендиаминкобальт(II) Хелаты. Комплексоны. Краун-эфиры](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/565230/slide-47.jpg)





 Реакционная способность углеводородов
Реакционная способность углеводородов Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Жесткость воды и способы ее устранения
Жесткость воды и способы ее устранения Основания LiOH - гидроксид лития
Основания LiOH - гидроксид лития Розв’язування задач і вправ з теми Алкани. 9 клас
Розв’язування задач і вправ з теми Алкани. 9 клас Аминдердің химиялық қасиеттері
Аминдердің химиялық қасиеттері Исследование соединений со структурой слоистого перовскита
Исследование соединений со структурой слоистого перовскита Химические реакции
Химические реакции Буферное кислотно - основное взаимодействие
Буферное кислотно - основное взаимодействие Неметаллы VIА-подгруппы
Неметаллы VIА-подгруппы Презентация по Химии "«Кислоты" - скачать смотреть бесплатно
Презентация по Химии "«Кислоты" - скачать смотреть бесплатно Строение и свойства циклоалканов
Строение и свойства циклоалканов Химия в повседневной жизни человека
Химия в повседневной жизни человека Жидкие системы
Жидкие системы Введение в химию. 8 класс
Введение в химию. 8 класс Простые вещества металлы
Простые вещества металлы Закон сохранения массы веществ
Закон сохранения массы веществ Аттестационная работа. Разработка по выполнению исследовательской работы. Выращивание кристаллов в домашних условиях
Аттестационная работа. Разработка по выполнению исследовательской работы. Выращивание кристаллов в домашних условиях Гормоны гипофиза. (Лекция 12)
Гормоны гипофиза. (Лекция 12) Алюминиевые сплавы
Алюминиевые сплавы Конструкционные функциональные волокнистые композиты
Конструкционные функциональные волокнистые композиты Organic compounds: nomenclature
Organic compounds: nomenclature Состав, строение, классификация кислот
Состав, строение, классификация кислот Основные понятия химии. Законы стехиометрии
Основные понятия химии. Законы стехиометрии Взаимодействие элементов-неметаллов между собой. 8 класс
Взаимодействие элементов-неметаллов между собой. 8 класс Изотопы, их свойства и применение
Изотопы, их свойства и применение Олиго- и гомополисахариды
Олиго- и гомополисахариды Геохимия природных процессов. Редкие элементы, как индикаторы геодинамических обстановок формирования комплексов. (Лекция 5)
Геохимия природных процессов. Редкие элементы, как индикаторы геодинамических обстановок формирования комплексов. (Лекция 5)