Содержание
- 2. Кристалл Жидкость Газ В температурной последовательности жидкое состояние - промежуточное между кристалли-ческим и газообразным
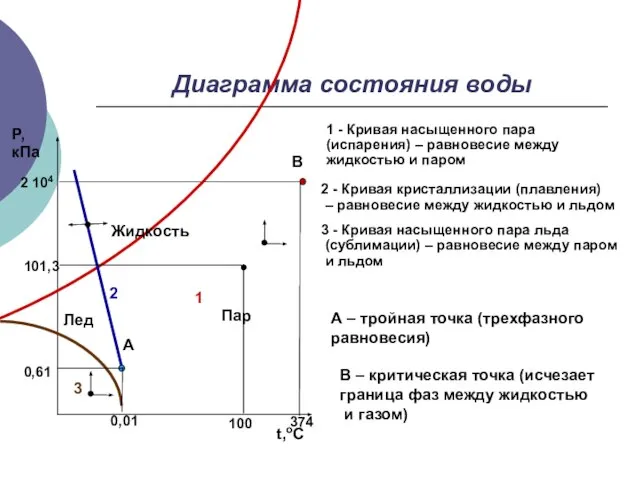
- 3. Диаграмма состояния воды 1 - Кривая насыщенного пара (испарения) – равновесие между жидкостью и паром 0,01
- 4. 8.2. Общие представления о растворах Растворы – это гомогенные (однофазные) системы, состоящие из двух и более
- 5. Классификация растворов (по агрегатному состоянию) Растворы Газообразные Воздух, природный газ Жидкие Растворы NaCl, H2S04 Твердые Стали
- 6. Способы выражения состава растворов Массовая доля – масса растворенного вещества, отнесенная к массе всего раствора, выражается
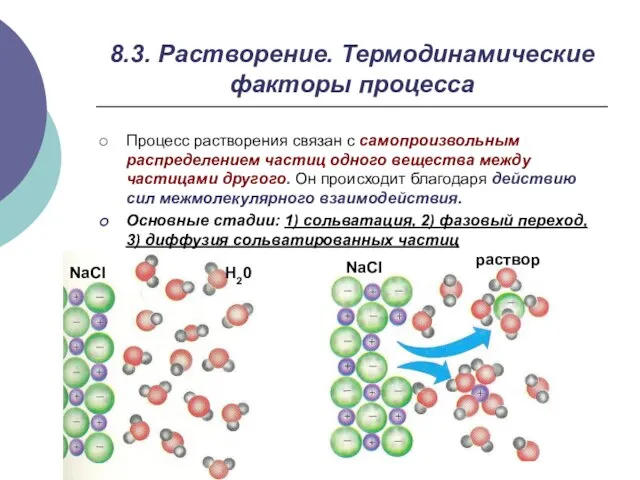
- 7. 8.3. Растворение. Термодинамические факторы процесса Процесс растворения связан с самопроизвольным распределением частиц одного вещества между частицами
- 8. Растворение – самопроизвольный процесс: ΔG ΔHр. = ΔHсольв.+ ΔHф.п.+ ΔHдиф ΔHсольв ΔHф.п>0 при растворении твердого вещества.
- 9. Тепловой эффект процесса растворения определяется соотношением | ΔHф.п|, |ΔHдиф| и | ΔHсольв| С повышением температуры -
- 10. Изменение энтропии: ΔSр. = ΔSсольв.+ ΔSф.п.+ ΔSдиф ΔSсольв ΔSф.п ΔSф.п 0 для жидкостей, ΔSф.п>0 для твердых
- 11. Процесс растворения определяется: - природой растворителя и растворенного вещества; - агрегатным состоянием растворяемого вещества; - температурой.
- 12. 8.4. Растворимость Растворенное вещество + растворитель = раствор, ΔG Растворенное вещество + растворитель = раствор, ΔG=0
- 13. 8.5. Общие свойства растворов Идеальным называется гипотетический раствор, образованный веществами, имеющими строго одинаковые размеры частиц и
- 14. Закон Рауля (1888 г) Сs,ps 0,5Сs, 0,5ps Относительное понижение давления насыщенного пара растворителя над раствором равно
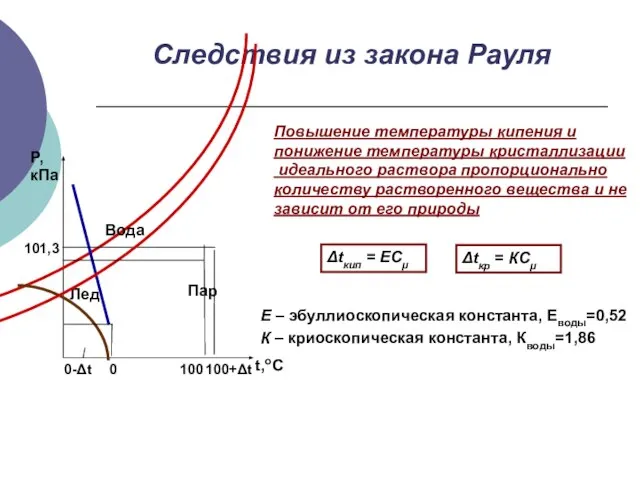
- 15. Следствия из закона Рауля Повышение температуры кипения и понижение температуры кристаллизации идеального раствора пропорционально количеству растворенного
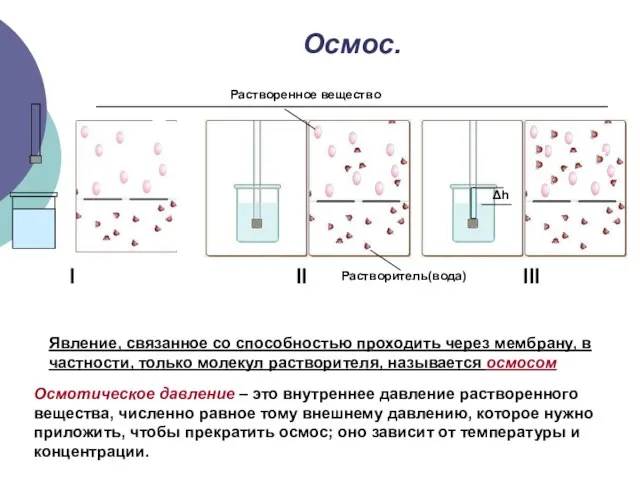
- 16. Осмос. I II Δh III Растворенное вещество Явление, связанное со способностью проходить через мембрану, в частности,
- 18. Скачать презентацию











 Химические Недотроги
Химические Недотроги  Гетероциклические соединения. Шестичленные гетероциклы с одним гетероатомом
Гетероциклические соединения. Шестичленные гетероциклы с одним гетероатомом Биохимия соединительной ткани
Биохимия соединительной ткани Силикаты. Классификация силикатов
Силикаты. Классификация силикатов Выполнила: Смирнова Маргарита Ученица: 9-а класса
Выполнила: Смирнова Маргарита Ученица: 9-а класса Презентация по Химии "«Подгруппа углерода»" - скачать смотреть
Презентация по Химии "«Подгруппа углерода»" - скачать смотреть  Презентация по Химии "Химия в разных науках" - скачать смотреть
Презентация по Химии "Химия в разных науках" - скачать смотреть  Неорганические вещества
Неорганические вещества Методы количественного определения «металлических» ядов в минерализате (деструктате)
Методы количественного определения «металлических» ядов в минерализате (деструктате) Кислотно-основное титрование в неводных средах
Кислотно-основное титрование в неводных средах Amino acid and protein metabolism II
Amino acid and protein metabolism II Презентация по химии Ученика 10 «А» класса Амелина Станислава
Презентация по химии Ученика 10 «А» класса Амелина Станислава Минералы соединения ртути
Минералы соединения ртути Муниципальное общеобразовательное учреждение Средняя общеобразовательная школа № 73» Тема проекта: Гидролиз органических веще
Муниципальное общеобразовательное учреждение Средняя общеобразовательная школа № 73» Тема проекта: Гидролиз органических веще Химические реакции спиртов
Химические реакции спиртов Повышение эффективности процесса сополимеризации бутадиена и α-метилстирола. Производительность 83000 т/год
Повышение эффективности процесса сополимеризации бутадиена и α-метилстирола. Производительность 83000 т/год Химия вокруг нас
Химия вокруг нас c4bf82f888b84ff1b75efb1a64c84b0f
c4bf82f888b84ff1b75efb1a64c84b0f Кислотно-основное титрование. 4 лекция. Часть 2
Кислотно-основное титрование. 4 лекция. Часть 2 Презентація з хімії 11 клас «Ізомерія»
Презентація з хімії 11 клас «Ізомерія»  Химическая кинетика
Химическая кинетика Горіння твердих речовин
Горіння твердих речовин ФОСФОР «СВЕТОНОСНЫЙ»
ФОСФОР «СВЕТОНОСНЫЙ» Химические элементы в организме человека Выполнил ученик 9 «Г» класса МОУ «сош №50» Жадан Михаил
Химические элементы в организме человека Выполнил ученик 9 «Г» класса МОУ «сош №50» Жадан Михаил Экологический проект Тема: Лабораторное исследование химического состава чипсов Работу выполнила Купавцева Татьяна
Экологический проект Тема: Лабораторное исследование химического состава чипсов Работу выполнила Купавцева Татьяна  Типы химических реакций на примере свойств воды.
Типы химических реакций на примере свойств воды.  Презентация по Химии "Золото" - скачать смотреть бесплатно
Презентация по Химии "Золото" - скачать смотреть бесплатно Каталітичний крекінг. Основні етапи становлення технології каталітичного крекінгу. Каталізатор крекінгу
Каталітичний крекінг. Основні етапи становлення технології каталітичного крекінгу. Каталізатор крекінгу