ПРИМЕНЕНИЕ:
• при изготовлении электролита для аккумуляторов;
• при изготовлении смазочных материалов, обладающих
высокой стабильностью механических показателей при значительном изменении температуры (от –60°C до 160°C).
• в химической промышленности, как реагент для получения соединений Li, в частности олеатов, стеаратов и пальмитатов;
• для очистки и кондиционирования воздуха, как поглотитель СО2 в противогазах, подводных лодках, самолетах и космических кораблях,
• в стекольной и керамической промышленности
• в радиотехнике и др.





 Различные способы решения задач на смеси, сплавы, растворы
Различные способы решения задач на смеси, сплавы, растворы 1oe_zanyatie (1)
1oe_zanyatie (1) Комбинированные задачи. Задание 34
Комбинированные задачи. Задание 34 Катализ органических реакций. (Лекция 15)
Катализ органических реакций. (Лекция 15) Хлорид натрия (NaCI)
Хлорид натрия (NaCI) Алкилирование изобутана олефинами
Алкилирование изобутана олефинами Лекция 10. Химия s-элементов
Лекция 10. Химия s-элементов Алканы и алкены
Алканы и алкены Углеводы. Моносахариды
Углеводы. Моносахариды Соли в свете теории электролитической диссоциации
Соли в свете теории электролитической диссоциации Задачи на электролиз. 11 класс Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.
Задачи на электролиз. 11 класс Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С. 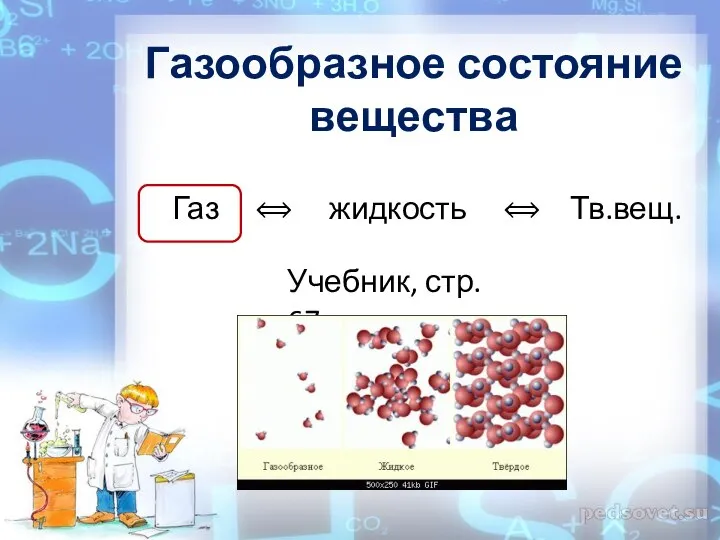 Газообразное состояние вещества
Газообразное состояние вещества Термодинамика. Химическая термодинамика
Термодинамика. Химическая термодинамика Аминокислоты ароматического ряда и их производные
Аминокислоты ароматического ряда и их производные Закономерности процессов тепло- и газообмена на пожаре
Закономерности процессов тепло- и газообмена на пожаре Химическая связь
Химическая связь Закон сохранения массы веществ
Закон сохранения массы веществ Проект установки каталитического риформинга мощностью 1200 тыс. тонн
Проект установки каталитического риформинга мощностью 1200 тыс. тонн Электролиз
Электролиз Методы установления механизмов органических реакций. (Лекция 4)
Методы установления механизмов органических реакций. (Лекция 4) Переробка горючих сланців підготував учень 11-В класу Котенко Роман
Переробка горючих сланців підготував учень 11-В класу Котенко Роман  СӨЖ Көмірсулар
СӨЖ Көмірсулар Оксиды азота
Оксиды азота Термодинамические характеристики многокомпонентных систем. Растворы. Основные понятия и определения
Термодинамические характеристики многокомпонентных систем. Растворы. Основные понятия и определения Муниципальное общеобразовательное учреждение Средняя общеобразовательная школа № 73» Тема проекта: Гидролиз органических веще
Муниципальное общеобразовательное учреждение Средняя общеобразовательная школа № 73» Тема проекта: Гидролиз органических веще Кинетическое лимитирование роста и жизненные стратегии микроорганизмов
Кинетическое лимитирование роста и жизненные стратегии микроорганизмов Химические элементы в организме человека
Химические элементы в организме человека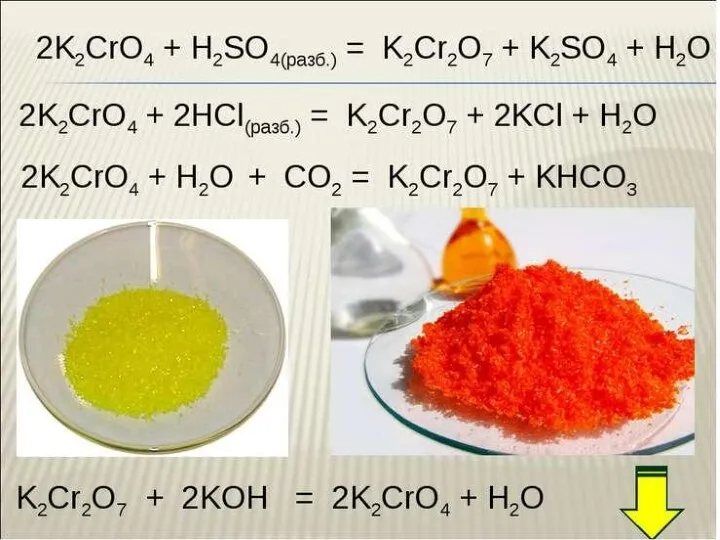 Хром. Соединения хрома
Хром. Соединения хрома