Содержание
- 2. К/Р Cu2S + O2 -> Cu2O + SO2 Cu2S + O2 -> CuO + SO2 Cu2S
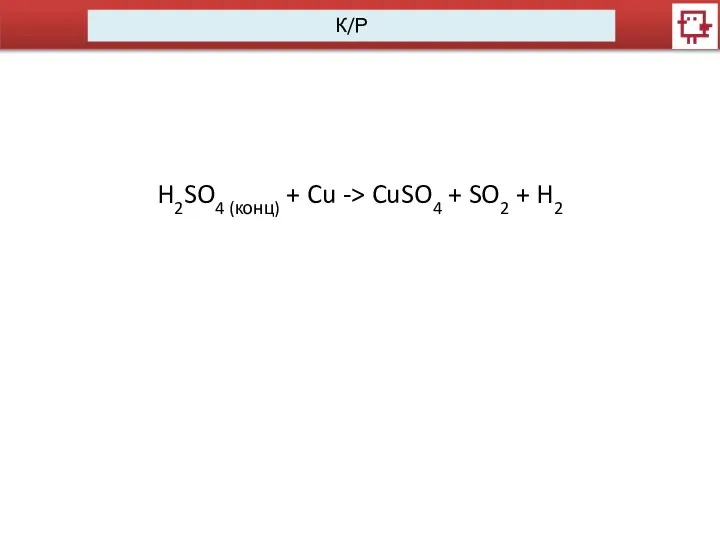
- 3. К/Р H2SO4 (конц) + Cu -> CuSO4 + SO2 + H2
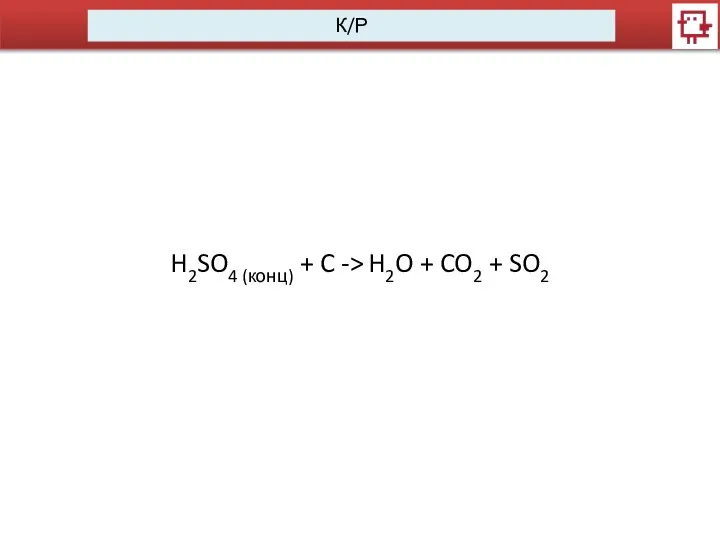
- 4. К/Р H2SO4 (конц) + C -> H2O + CO2 + SO2
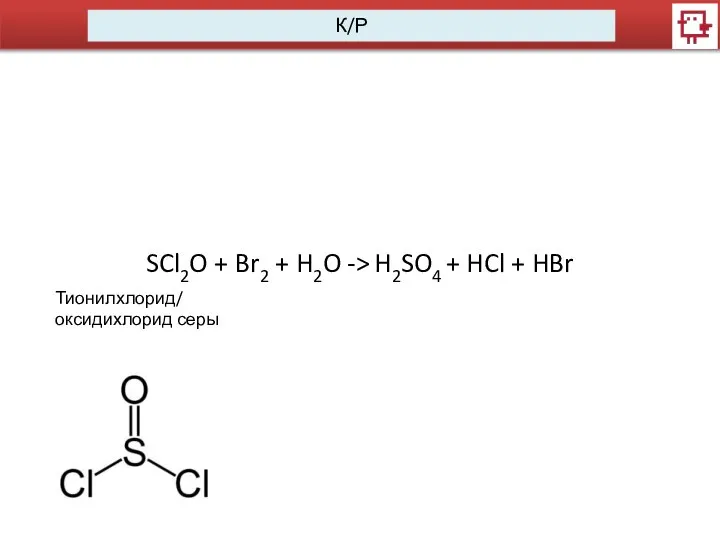
- 5. К/Р SCl2O + Br2 + H2O -> H2SO4 + HCl + HBr Тионилхлорид/ оксидихлорид серы
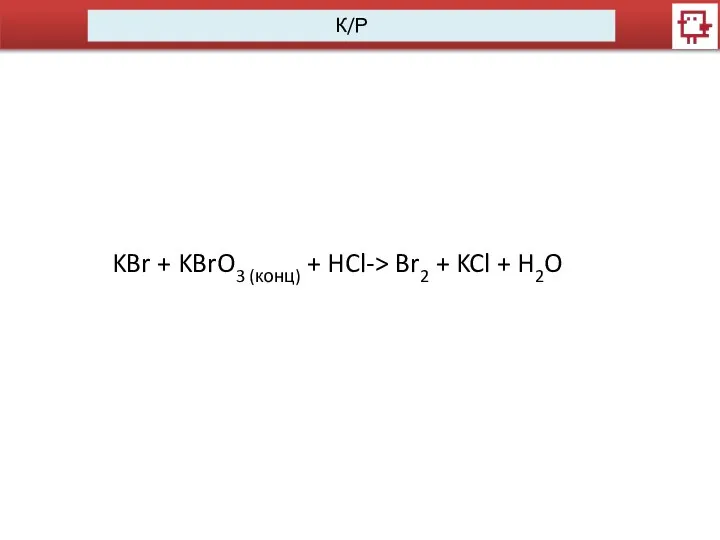
- 6. К/Р KBr + KBrO3 (конц) + HCl-> Br2 + KCl + H2O
- 7. К/Р KBr + KMnO4 + H2SO4 -> Br2 + MnSO4 + H2O + K2SO4
- 8. К/Р Ce(SO4)2 + H2O2 -> Ce(SO4)3 + O2 + H2SO4
- 9. К/Р KMnO4 + KHSO3 -> K2SO4 + KHSO4 + MnO2 + H2O
- 10. 6я группа элементов 28.11.2016 3е занятие 2го триместра
- 11. Распространенность 6я группа главная подгруппа содержит элементы: О S Se Te На долю кислорода приходится около
- 12. Химические свойства кислорода О – второй по электроотрицательности элемент. С большинством металлов О реагирует при комнатной
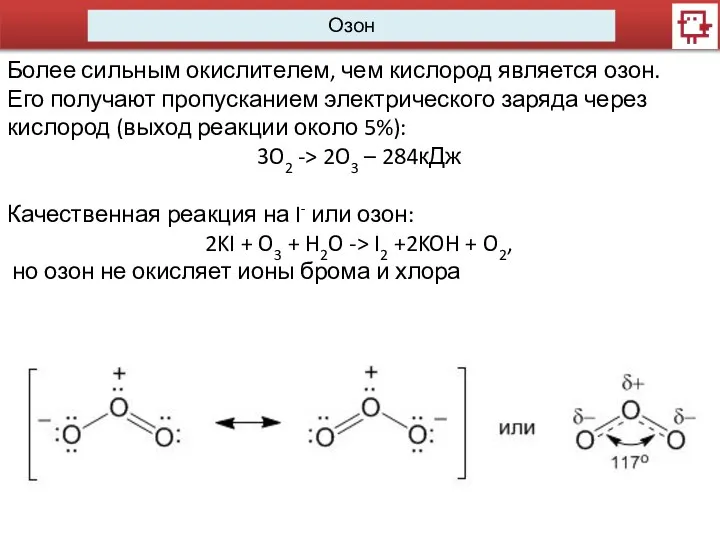
- 13. Озон Более сильным окислителем, чем кислород является озон. Его получают пропусканием электрического заряда через кислород (выход
- 14. Получение В промышленности получают: Фракционной перегонкой жидкого воздуха (разность температур конденсации) Электролизом воды В лаборатории: 2KMnO4
- 15. Сера При комнатной температуре сера реагирует со фтором, хлором и концентрированными кислотами-окислителями (HNO3, H2SO4): S +
- 16. Сероводород Сероводород – бесцветный и очень токсичный газ с запахом тухлых яиц. Получение в лаборатории: FeS
- 17. Сернистый газ. Сернистая кислота SO2 + H2O H2SO3 Сернистый газ можно получить при взаимодействии: Me +
- 19. Скачать презентацию











 Происхождение нефти
Происхождение нефти Мило. Мийні засоби
Мило. Мийні засоби  Ионный обмен или сорбция
Ионный обмен или сорбция Эпоксидные смолы
Эпоксидные смолы Растворы. Основные понятия. Концентрация. Законы Рауля
Растворы. Основные понятия. Концентрация. Законы Рауля Лекарственные средства, производные барбитуровой кислоты
Лекарственные средства, производные барбитуровой кислоты Phase formation rules for high entropy alloys
Phase formation rules for high entropy alloys Алканы. Хлороформ
Алканы. Хлороформ Горечи. Лекция 3
Горечи. Лекция 3 8 класс. РЕШЕНИЕ ЗАДАЧ ПО УРАВНЕНИЯМ ХИМИЧЕСКИХ РЕАКЦИЙ
8 класс. РЕШЕНИЕ ЗАДАЧ ПО УРАВНЕНИЯМ ХИМИЧЕСКИХ РЕАКЦИЙ Генетическая связь неорганических соединений
Генетическая связь неорганических соединений Хроматография. (Лекция 4)
Хроматография. (Лекция 4) Неорганические вещества клетки
Неорганические вещества клетки Сульфат меди
Сульфат меди Коррозия металлов
Коррозия металлов Механизмы двухсубстатных реакций
Механизмы двухсубстатных реакций Алканы. Алкены. Алкины
Алканы. Алкены. Алкины Неметаллы и их соединения
Неметаллы и их соединения Вещество. Состояние вещества. Кристаллические решётки
Вещество. Состояние вещества. Кристаллические решётки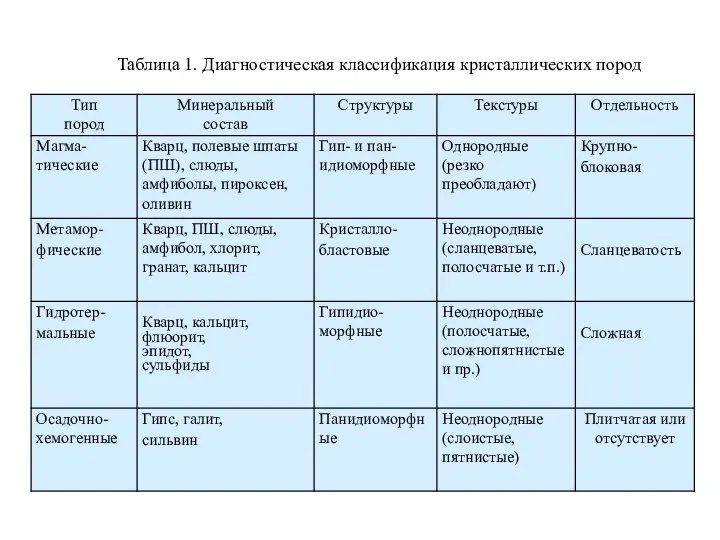 Диагностика метаморфических и гидротермальных горных пород
Диагностика метаморфических и гидротермальных горных пород Производные пиррола и индола. (Лекция 4)
Производные пиррола и индола. (Лекция 4) Презентация по Химии "Степень окисления" - скачать смотреть
Презентация по Химии "Степень окисления" - скачать смотреть  Гетерогенные и лигандообменные равновесия и процессы
Гетерогенные и лигандообменные равновесия и процессы Основания. Классификация оснований
Основания. Классификация оснований Металл золото
Металл золото Сравнение нормативов некоторых веществ
Сравнение нормативов некоторых веществ Производство топлив и масел
Производство топлив и масел История открытия жиров
История открытия жиров