Содержание
- 2. Обычно под коррозией металла понимают его окисление под влиянием кислот, которые присутствуют в растворах, контактирующих с
- 3. Виды коррозии Химическая коррозия Электрохимическая коррозия
- 4. Химическая коррозия. Под таким явлением понимают разрушение металла, вызываемое контактом коррозионной среды и материала. Причем при
- 6. Электрохимическая коррозия металлов отличается от химической тем, что последняя протекает без электротока. А первопричина этих видов
- 7. Существуют далее приведенные виды химической коррозии: - в жидких составах, которые не причисляются к электролитами; -
- 8. К жидкостям-неэлектролитам относят составы, неспособные проводить электроток: - неорганические: сера в расплавленном состоянии, жидкий бром; -
- 9. Процесс химического ржавления чаще всего идет в пять этапов: 1. Сначала к поверхности металла подходит окислитель.
- 10. Электрохимическая коррозия. Окислительно-восстановительная реакция, происходящая в средах, проводящих ток (в отличие от химической коррозии). Процесс происходит
- 11. На аноде (более активном металле) идет окисление атомов металла с образованием катионов (растворение). На катоде (менее
- 12. Скорость коррозии тем больше, чем сильнее отличаются металлы (металл и примеси) по своей активности (для металлов
- 14. Спасибо за внимание
- 15. Хемосорбция Поглощение одного вещества другим, сопровождающееся проявлением химических сил ← Назад
- 17. Скачать презентацию














 Коррозия углеродистых и низколегированных сталей в различных средах
Коррозия углеродистых и низколегированных сталей в различных средах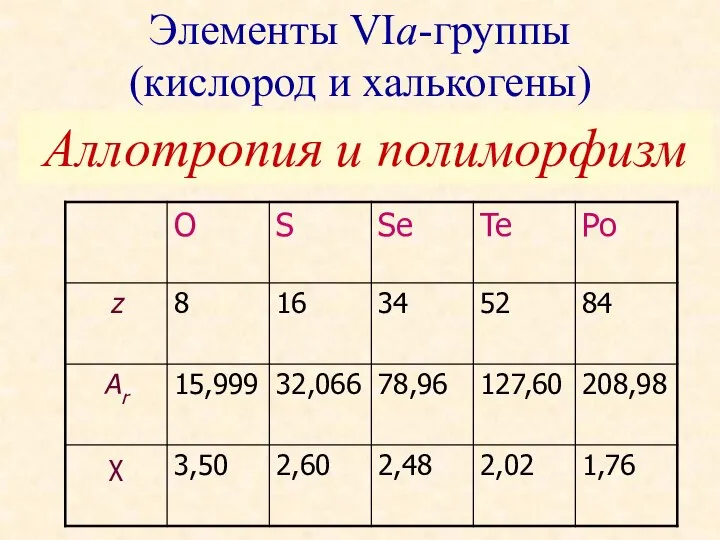 Элементы VIа-группы (кислород и халькогены). Аллотропия и полиморфизм
Элементы VIа-группы (кислород и халькогены). Аллотропия и полиморфизм Строение вещества
Строение вещества Процессы нитрозирования и основные реакции диазосоединений
Процессы нитрозирования и основные реакции диазосоединений Механизм и закономерности кристаллизации металлов
Механизм и закономерности кристаллизации металлов Автор: Васильева Е.Д. Учитель физики МОУ гимназия г.Советский
Автор: Васильева Е.Д. Учитель физики МОУ гимназия г.Советский Кремний. Основа неживой природы
Кремний. Основа неживой природы Гексены. Физические и химические свойства
Гексены. Физические и химические свойства Общая характеристика и классификация топлива
Общая характеристика и классификация топлива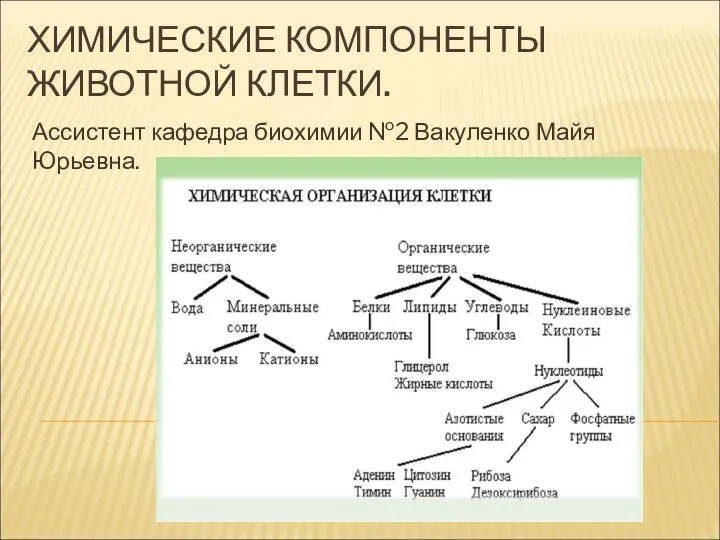 Химические компоненты животной клетки
Химические компоненты животной клетки Едкость Coca-Cola
Едкость Coca-Cola Методы защиты металлов от электрохимической коррозии
Методы защиты металлов от электрохимической коррозии Молекулярно-кінетичні явища в дисперсних системах
Молекулярно-кінетичні явища в дисперсних системах Ткаченко Ірина Іванівна, вчитель хімії Черкаської загальноосвітньої школи I-III ступенів № 21
Ткаченко Ірина Іванівна, вчитель хімії Черкаської загальноосвітньої школи I-III ступенів № 21  Окислительно-восстановительные реакции в органической химии
Окислительно-восстановительные реакции в органической химии Аналитическая химия и химический анализ. (Лекция 1)
Аналитическая химия и химический анализ. (Лекция 1) Презентация Сложные эфиры. Жиры.
Презентация Сложные эфиры. Жиры.  Химико-фармацевтические препараты
Химико-фармацевтические препараты Деятельность лабораторий контроля химических факторов. Совещание, итоги 2016 года
Деятельность лабораторий контроля химических факторов. Совещание, итоги 2016 года Растворы: состав и их коллигативные свойства
Растворы: состав и их коллигативные свойства Молярный объём. Относительная плотность
Молярный объём. Относительная плотность Минеральный состав пород
Минеральный состав пород Аттестационная работа. Методразработка по проведению исследовательской работы «Выращивание кристаллов в домашних условиях»
Аттестационная работа. Методразработка по проведению исследовательской работы «Выращивание кристаллов в домашних условиях» Амоніак
Амоніак  Водень та його застосування в енергетиці
Водень та його застосування в енергетиці  Реакции соединения
Реакции соединения Скорость химической реакции
Скорость химической реакции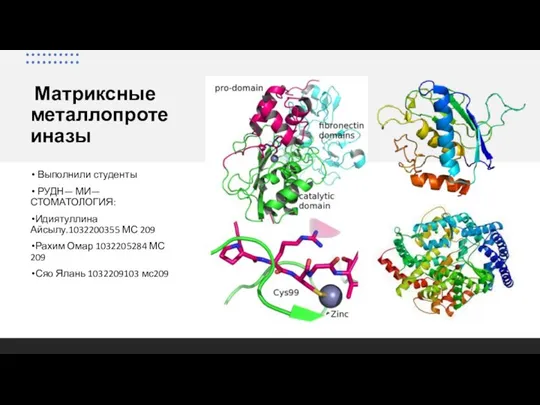 Матриксные металлопротеиназы
Матриксные металлопротеиназы