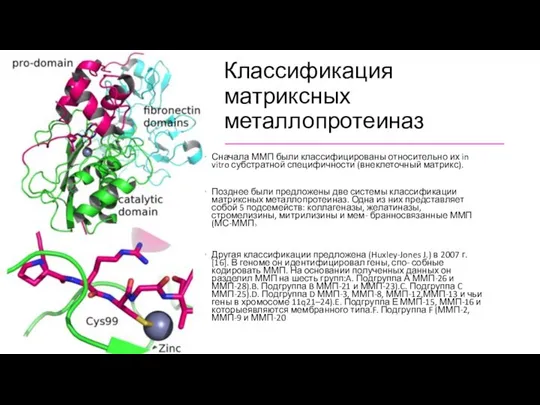
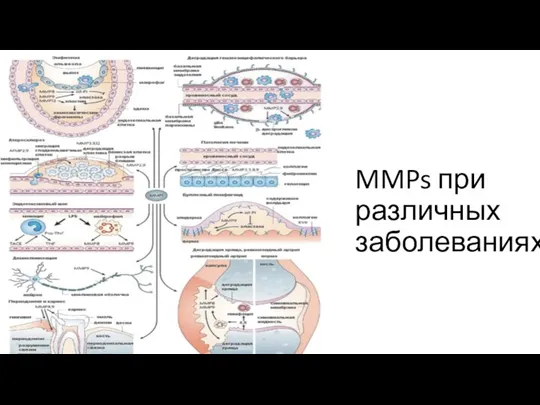
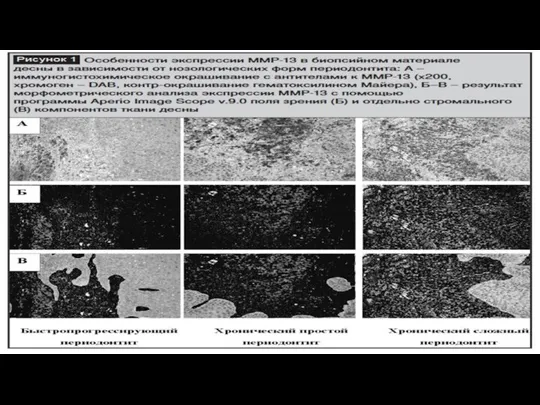
Классификация матриксных металлопротеиназ
Сначала ММП были классифицированы относительно их in vitro субстратной
специфичности (внеклеточный матрикс).
Позднее были предложены две системы классификации матриксных металлопротеиназ. Одна из них представляет собой 5 подсемейств: коллагеназы, желатиназы, стромелизины, митрилизины и мем- бранносвязанные ММП (МС-ММП )
Другая классификации предложена (Huxley-Jones J.) в 2007 г. [16]. В геноме он идентифицировал гены, спо- собные кодировать ММП. На основании полученных данных он разделил ММП на шесть групп:A. Подгруппа А ММП-26 и ММП-28).B. Подгруппа B ММП-21 и ММП-23).C. Подгруппа C ММП-25).D. Подгруппа D ММП-3, ММП-8, ММП-12,ММП-13 и чьи гены в хромосоме 11q21–24).E. Подгруппа Е ММП-15, ММП-16 и которыеявляются мембранного типа.F. Подгруппа F (ММП-2, ММП-9 и ММП-20







 Презентация по Химии "Дезінфікуючі засоби" - скачать смотреть бесплатно
Презентация по Химии "Дезінфікуючі засоби" - скачать смотреть бесплатно Едкость Coca-Cola
Едкость Coca-Cola Новые наноматериалы. Получение, свойства и применение
Новые наноматериалы. Получение, свойства и применение Кружок «Алхимия»
Кружок «Алхимия» Пентоза - відновлювальна сировина для синтезу фуранових сполук
Пентоза - відновлювальна сировина для синтезу фуранових сполук Натуральный и синтетический каучуки. Резина.
Натуральный и синтетический каучуки. Резина.  Роль химических элементов в жизнедеятельности организма
Роль химических элементов в жизнедеятельности организма Сплавы серебра
Сплавы серебра Почвоведение. Введение
Почвоведение. Введение Электроды 1 рода
Электроды 1 рода Вакуумное фильтрование
Вакуумное фильтрование Радиоматериалы и радиокомпоненты. Зонная теория
Радиоматериалы и радиокомпоненты. Зонная теория Аминокислоты ароматического ряда и их производные
Аминокислоты ароматического ряда и их производные Анализ качества лекарственных косметических веществ, определяемых методом комплексонометрии
Анализ качества лекарственных косметических веществ, определяемых методом комплексонометрии Моделирование (7 класс)
Моделирование (7 класс) Презентация по Химии "Строение атома" - скачать смотреть бесплатно_
Презентация по Химии "Строение атома" - скачать смотреть бесплатно_ Типы химических реакций. Реакция соединения
Типы химических реакций. Реакция соединения Презентация по Химии "Органічні розчинники" - скачать смотреть бесплатно
Презентация по Химии "Органічні розчинники" - скачать смотреть бесплатно Общие свойства живых организмов
Общие свойства живых организмов Биохимия. Ферменты (Лекция№2)
Биохимия. Ферменты (Лекция№2) Презентация по Химии "Простые вещества – металлы" - скачать смотреть бесплатно
Презентация по Химии "Простые вещества – металлы" - скачать смотреть бесплатно Acids and alkalis
Acids and alkalis Тақырып. Ароматик көмірсутектер
Тақырып. Ароматик көмірсутектер Сабақтың тақырыбы: донорлыакцепторлы байланыс. Комплексті қосылыстар
Сабақтың тақырыбы: донорлыакцепторлы байланыс. Комплексті қосылыстар Гетерогенное ионное равновесие. Реакции обмена
Гетерогенное ионное равновесие. Реакции обмена Вакуумная перегонка мазута
Вакуумная перегонка мазута Названия алканов
Названия алканов "Вещества в твоей жизни" Урок химии в 9-м классе Учитель: Герасименко Е.В.
"Вещества в твоей жизни" Урок химии в 9-м классе Учитель: Герасименко Е.В.