Содержание
- 2. Химическая кинетика Что даёт знание скорости химической реакции Классификация реакций по фазовому составу Средняя скорость гомогенной
- 3. Химическая кинетика - это раздел химии, который изучает скорости химических реакций, их зависимость от различных факторов
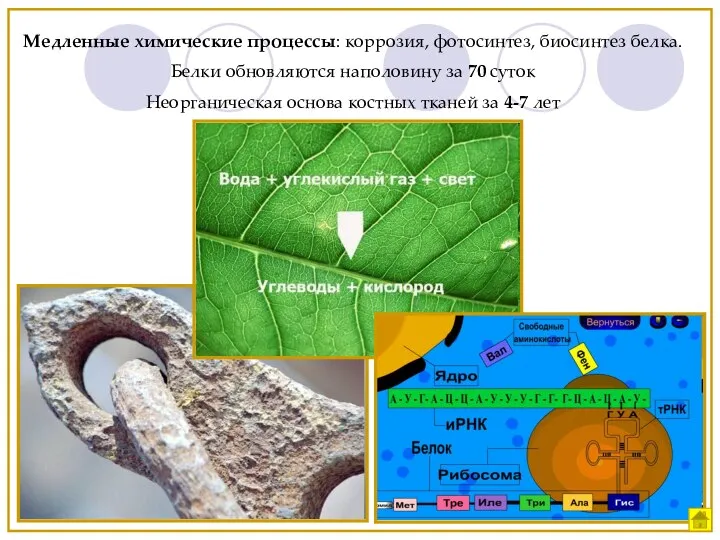
- 4. Медленные химические процессы: коррозия, фотосинтез, биосинтез белка. Белки обновляются наполовину за 70 суток Неорганическая основа костных
- 5. Знание скорости химической реакции имеет большое практическое значение позволяет замедлять или ускорять процессы, сопровождающие нас в
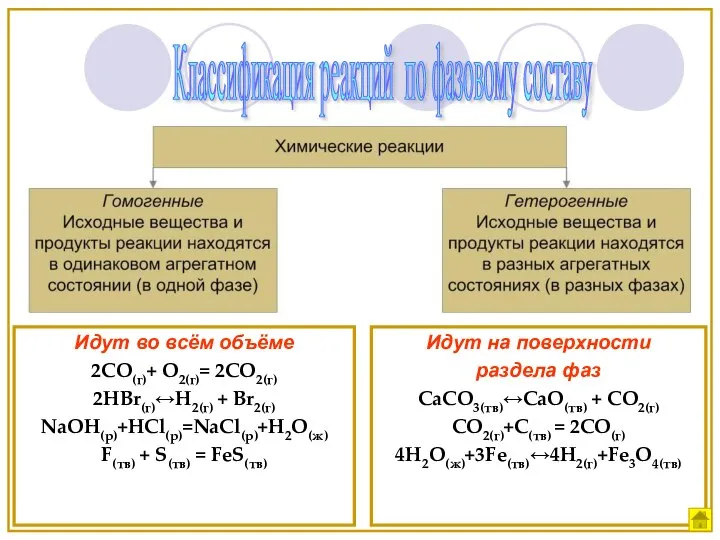
- 6. Идут во всём объёме 2СО(г)+ О2(г)= 2СО2(г) 2HBr(г)↔H2(г) + Br2(г) NaOH(р)+HCl(р)=NaCl(р)+H2O(ж) F(тв) + S(тв) = FeS(тв)
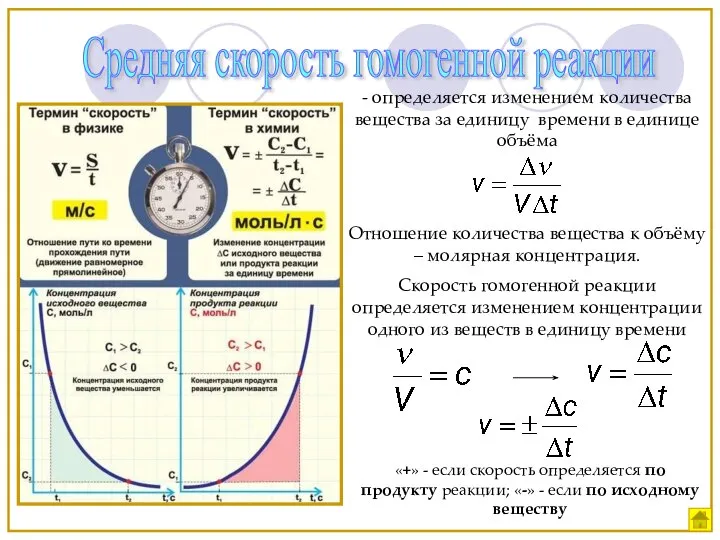
- 7. Средняя скорость гомогенной реакции - определяется изменением количества вещества за единицу времени в единице объёма Отношение
- 8. Средняя скорость гетерогенной реакции - определяется изменением количества вещества, вступившего в реакцию или образовавшегося в результате
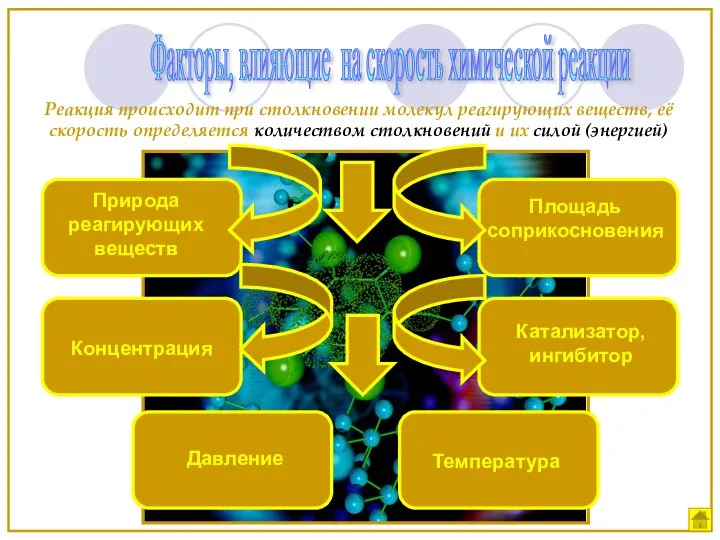
- 9. Факторы, влияющие на скорость химической реакции Природа реагирующих веществ Концентрация Температура Катализатор, ингибитор Площадь соприкосновения Реакция
- 10. Природа реагирующих веществ Реакционная активность веществ определяется: характером химических связей скорость больше у веществ с ионной
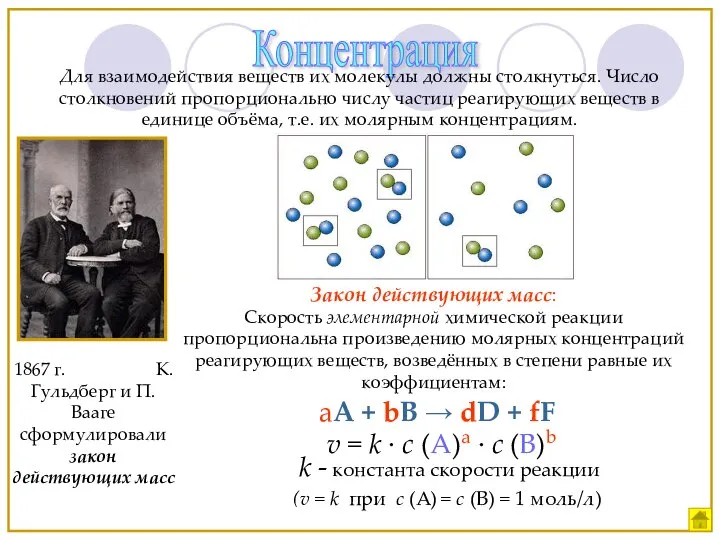
- 11. Концентрация Для взаимодействия веществ их молекулы должны столкнуться. Число столкновений пропорционально числу частиц реагирующих веществ в
- 12. Сванте Аррениус (1859-1927) Объяснение зависимости скорости реакции от температуры было дано С.Аррениусом. К реакции приводит не
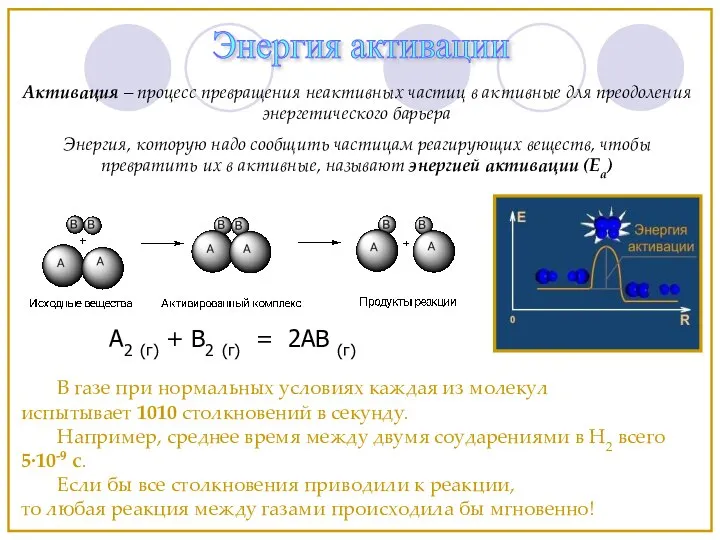
- 13. Энергия активации В газе при нормальных условиях каждая из молекул испытывает 1010 столкновений в секунду. Например,
- 14. Якоб Вант-Гофф (1852-1911) Температура повышает количество столкновений молекул. Правило Вант-Гоффа (сформулировано на основании экспериментального изучения реакций)
- 15. Катализаторы Йенс Якоб Берцелиус ввел термин «катализ» в 1835 г. Вильгельм Оствальд 1909 г. – Нобелевская
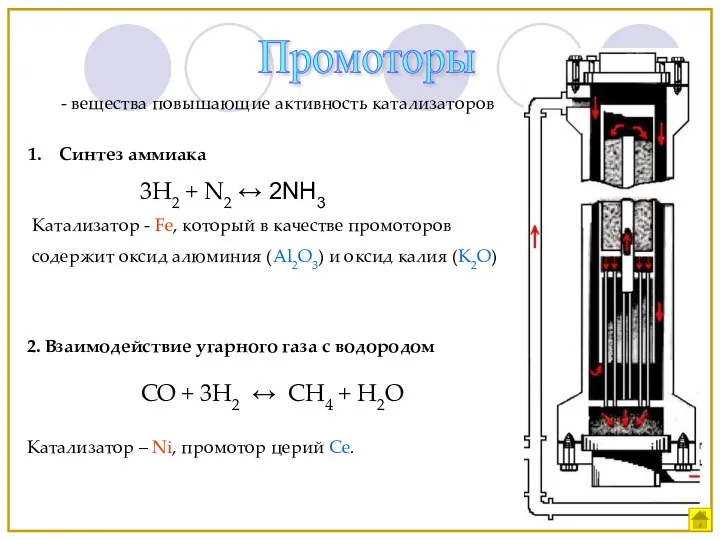
- 16. Промоторы - вещества повышающие активность катализаторов Синтез аммиака 3H2 + N2 ↔ 2NH3 Катализатор - Fe,
- 17. Давление Давление сильно влияет на скорость реакций с участием газов, потому что оно непосредственно определяет их
- 18. Площадь соприкосновения Скорость гетерогенной реакции прямо пропорциональна площади поверхности соприкосновения реагентов. При измельчении и перемешивании увеличивается
- 19. Задачи 1. Вычислите среднюю скорость химической реакции, если через 20 с от начала реакции концентрация веществ
- 20. Дано: При уменьшении объёма смеси в 2 раза концентрация каждого вещества возрасла в 2 раза c2
- 21. Дано: c1 (А)= 1моль/л с1(В) = 3моль/л Найти: v1/v2 1) Запишем закон действующих масс для данной
- 22. 4. Как изменится скорость реакции 2Fe + 3Cl2 = 2FeCl3, если давление системы увеличить в 5
- 23. 1) Запишем выражение зависимости скорости реакции от температуры: υ2 = υ1 ∙ γ∆τ/10 2) Найдём отношение
- 24. 6. Реакция при 50 °С протекает за 2 мин 15 с. За какое время закончится эта
- 25. 7. Скорость реакции при охлаждении от 80° до 60 °С уменьшилась в 4 раза. Найти температурный
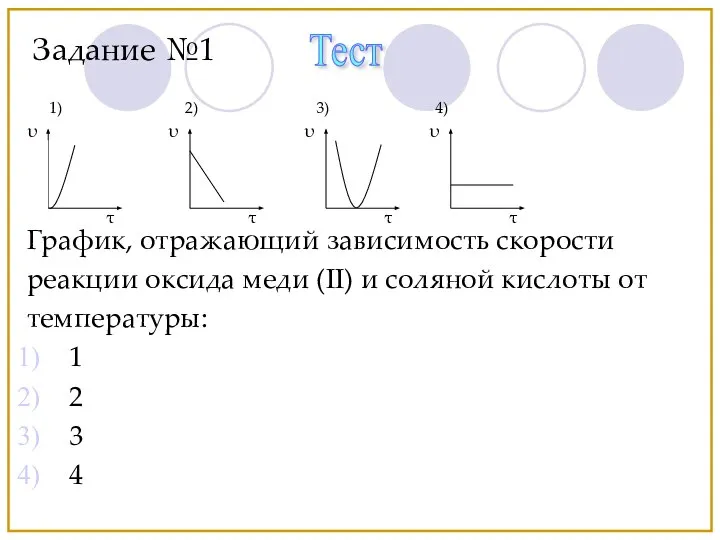
- 26. График, отражающий зависимость скорости реакции оксида меди (II) и соляной кислоты от температуры: 1 2 3
- 27. Задание №2 Какой из факторов не оказывает влияния на скорость химической реакции в растворах: концентрация веществ
- 28. На скорость химической реакции между раствором серной кислоты и железом не оказывает влияния: концентрация кислоты измельчение
- 29. Во сколько раз изменится скорость элементарной реакции 2А + В = А2В, если концентрацию вещества В
- 30. Как повлияет на скорость элементарной реакции А + В = АВ увеличение концентрации вещества А в
- 31. Быстрее при комнатной температуре будет протекать реакция между 10% раствором соляной кислоты и: цинком в гранулах
- 32. В течение одной минуты выделится больше водорода, если для реакции использовать: Zn(гранулы) и CH3COOH(10% раствор) Zn(порошок)
- 33. При увеличении температуры от 10° до 30° С скорость реакции, температурный коэффициент которой γ = 3:
- 34. Для уменьшения скорости химической реакции необходимо: увеличить концентрацию реагирующих веществ ввести в систему катализатор повысить температуру
- 35. Скорость химической реакции между медью и азотной кислотой зависит от: массы меди объёма кислоты концентрации кислоты
- 37. Скачать презентацию


























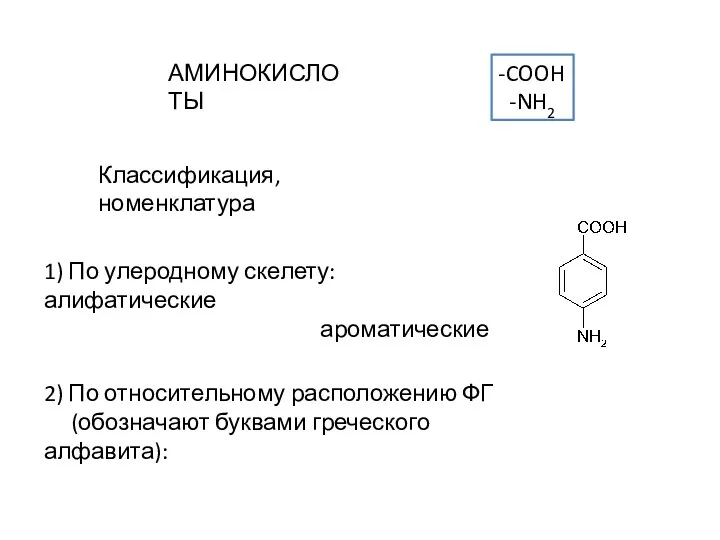 Аминокислоты. Классификация, номенклатура
Аминокислоты. Классификация, номенклатура Фазовые равновесия
Фазовые равновесия Электролитическая диссоциация
Электролитическая диссоциация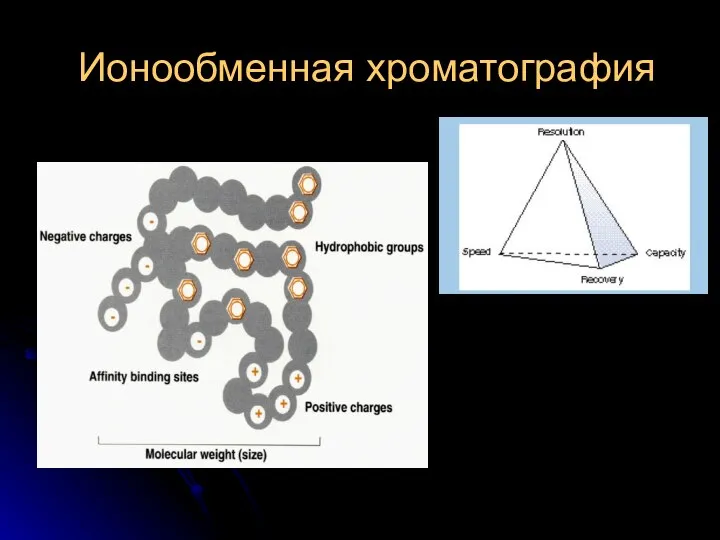 Ионообменная хроматография
Ионообменная хроматография Мұнай құрамындағы тұздың мөлшерін анықтау
Мұнай құрамындағы тұздың мөлшерін анықтау Биохимия печени
Биохимия печени Потенциометрия. Методы потенциометрии, и их применение в медицине. Плюсы и минусы методов ПТ
Потенциометрия. Методы потенциометрии, и их применение в медицине. Плюсы и минусы методов ПТ Кристаллические решетки
Кристаллические решетки Атомные спектры
Атомные спектры Азотная кислота и ее соли. Раскаленный уголек, брошенный в концентрированную азотную кислоту, продолжает гореть, при этом выде
Азотная кислота и ее соли. Раскаленный уголек, брошенный в концентрированную азотную кислоту, продолжает гореть, при этом выде Высокопроизводительное моторное масло для бензиновых и дизельных двигателей
Высокопроизводительное моторное масло для бензиновых и дизельных двигателей Добавки, красители и консерванты в пищевых продуктах
Добавки, красители и консерванты в пищевых продуктах «Адамсит». Дигидрофенарсазинхлорид HN(C6H4)2AsCl
«Адамсит». Дигидрофенарсазинхлорид HN(C6H4)2AsCl Метасоматический процесс
Метасоматический процесс Относительная атомная масса
Относительная атомная масса Адские задания. ЕГЭ по химии
Адские задания. ЕГЭ по химии Презентация по Химии "Хімія в повсякденному житті" - скачать смотреть бесплатно
Презентация по Химии "Хімія в повсякденному житті" - скачать смотреть бесплатно Классификация неорганических веществ
Классификация неорганических веществ Ферроцен. Свойства, получение и применение
Ферроцен. Свойства, получение и применение Правила техники безопасности при работе в химическом кабинете. Ознакомление с лабораторным оборудованием. Инструктаж по ТБ
Правила техники безопасности при работе в химическом кабинете. Ознакомление с лабораторным оборудованием. Инструктаж по ТБ Спирт. Спирты в природе. Влияние спирта на человека
Спирт. Спирты в природе. Влияние спирта на человека Физические и химические свойства воды
Физические и химические свойства воды Электрохимические методы. (Лекция 3)
Электрохимические методы. (Лекция 3) Такая знакомая сода
Такая знакомая сода Электролиз. 9 класс
Электролиз. 9 класс Биохимия лёгких
Биохимия лёгких Кафедры биохимии УГМУ в прошлом и настоящем
Кафедры биохимии УГМУ в прошлом и настоящем Состав вещества
Состав вещества