Содержание
- 2. Изучение электрохимического процесса – коррозии металла, видов коррозии, экспериментальное исследование условий возникновения коррозионных микроэлементов, влияния различных
- 3. U-образная трубка; Железный и угольный стержни; Химический стакан – 2 шт.; Пробирки - 5 шт.; Железная
- 4. Теоретическое положение Коррозия - это самопроизвольный электрохимический процесс разрушения металлов и сплавов в результате их окисления
- 5. Деполяризация – процесс отвода электронов с катодных участков, а вещества, применяемые для этого – деполяризаторами. Анодный
- 6. Схемы работы микрогальванических элементов Коррозия с кислородной деполяризацией: Коррозия с водородной деполяризацией:
- 7. Опыт № 1. Коррозия железа в контакте с углеродом Заполните U-образную трубку на ½ объема 0,5
- 8. Опыт № 2. Контактная коррозия цинка В две пробирки налить по ¼ 2 н. раствора серной
- 10. Скачать презентацию







 Тема: “Загальна характеристика основ”.
Тема: “Загальна характеристика основ”.  Природні гази
Природні гази Метаболизм этанола
Метаболизм этанола Химическое уравнение
Химическое уравнение Презентация по Химии "Углеводы" - скачать смотреть
Презентация по Химии "Углеводы" - скачать смотреть 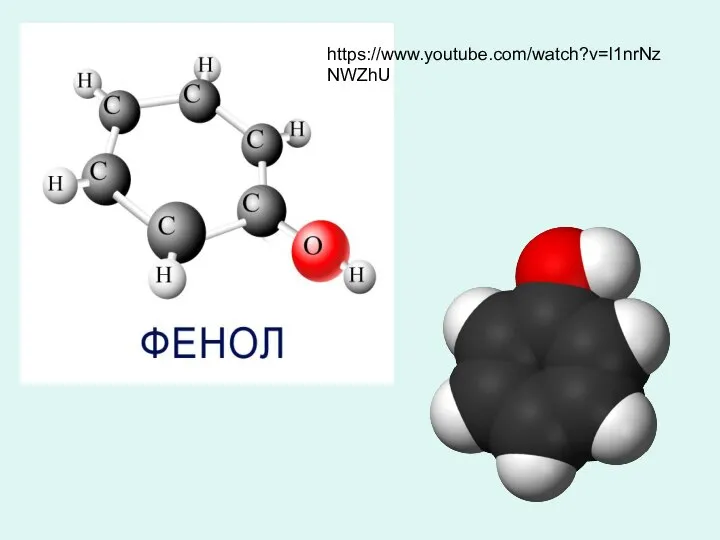 Фенол. Феноловая катастрофа
Фенол. Феноловая катастрофа Валентность и ковалентность химической связи
Валентность и ковалентность химической связи Взаимодействие веществ
Взаимодействие веществ Інсектициди для захисту сливи та персеку
Інсектициди для захисту сливи та персеку ПРИРОДНЫЕ ЯДЫ
ПРИРОДНЫЕ ЯДЫ Введение в химическую термодинамику
Введение в химическую термодинамику Особенности гигиенического нормирования экзогенных химических веществ в воде водоемов
Особенности гигиенического нормирования экзогенных химических веществ в воде водоемов Кислород
Кислород Ароматичні вуглеводні
Ароматичні вуглеводні Применение нитратов
Применение нитратов Кетоновые тела
Кетоновые тела Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы" - скачать смотреть бесплат
Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы" - скачать смотреть бесплат Аттестационная работа. Методическая разработка индивидуальной исследовательской работы по химии педагогического колледжа
Аттестационная работа. Методическая разработка индивидуальной исследовательской работы по химии педагогического колледжа Кремний и его соединения
Кремний и его соединения Сополимеризация. Основные количественные характеристики процесса сополимеризации
Сополимеризация. Основные количественные характеристики процесса сополимеризации Мои НИОКР металлорганической химии против рака, Альцгеймера и Паркинсона
Мои НИОКР металлорганической химии против рака, Альцгеймера и Паркинсона Условная оптимизация методом классического математического анализа с применением множителей
Условная оптимизация методом классического математического анализа с применением множителей Презентация по Химии "«Кислоты" - скачать смотреть бесплатно
Презентация по Химии "«Кислоты" - скачать смотреть бесплатно Аминокислоты, белки
Аминокислоты, белки Метанол. Фізичні властивості
Метанол. Фізичні властивості Загальна характеристика галогенів. (Тема 7)
Загальна характеристика галогенів. (Тема 7) Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Выделение нефтегазоматеринских пород по данным пиролиза. Построение геохимического разреза
Выделение нефтегазоматеринских пород по данным пиролиза. Построение геохимического разреза