Содержание
- 2. Мета уроку: 1. Познайомити учнів з новим класом неорганічних сполук – основами. 2. Розглянути класифікацію, склад
- 3. Будова основ та їх назви Класифікація Фізичні властивості Хімічні властивості Застосування в побуті та промисловості Правила
- 4. Основи – це складні речовини, в яких йони металів з’єднані з одною чи декільками гідроксид-йонами. NaOH
- 5. Схема утворення натрій: гідроксиду структурна формула води (Н2О): Н – О – Н 2Na + 2HOH
- 6. Оксидам металів відповідають основи: Складіть основи з оксидів: ZnO, Li2O, MgO. Спробуйте самостійно скласти оксиди з
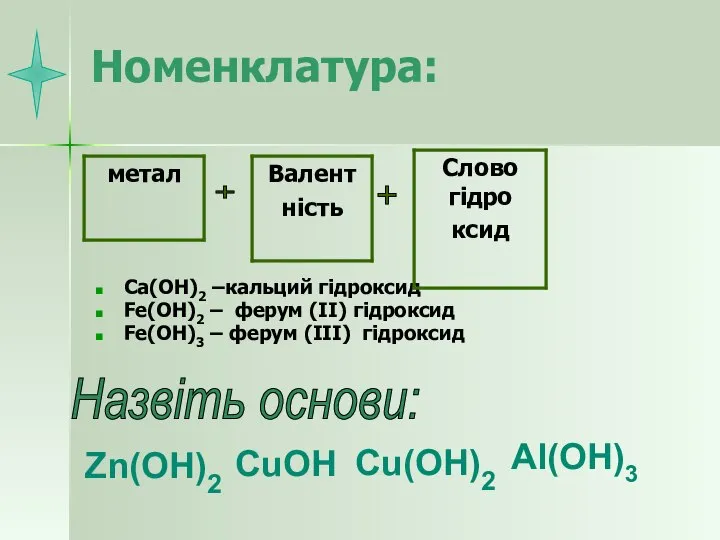
- 7. Номенклатура: Ca(OH)2 –кальций гідроксид Fe(OH)2 – ферум (ІІ) гідроксид Fe(OH)3 – ферум (ІІІ) гідроксид + +
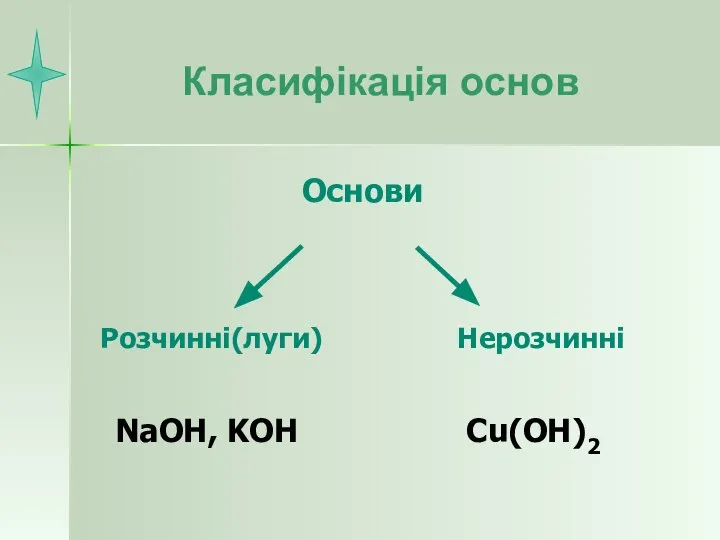
- 8. Класифікація основ NaOH, KOH Cu(OH)2
- 9. Фізичні властивості основ :Калій гідроксид
- 10. Кальцій гідроксид
- 11. Купрум(ІІ) гідроксид
- 12. Ферум(ІІ) гідроксид
- 13. Фізичні властивості основ: Тверді,кристалічні Ті,що утворюються під час реакцій Луги(розчинні) дуже їдкі Мають різні кольори
- 14. Хімічні властивості Взаємодіють з індикаторами: Фенол-фталеїн – малиновий Лакмус- синій
- 15. Взаємодіють з кислотами KOH+HCl= KCl+H2O Взаємодіють з кислотними оксидами 2KOH+CO2 =K2CO3+H2O Взаємодіють з солями KOH+NaCl=KCl+NaOH Нерозчинні
- 16. Добування В лабораторії: Розчиненням лужних металів у воді 2Na+2H2O=2NaOH+H2 CaO+H2O=Ca(OH)2 В промисловості електролізом розплавів нерозчинні основи
- 17. Застосування NaOH – для виробництва мила,ліків, в текстильній промисловості, очищування нафти. KOH - в аккумуляторах. Ca(OH)2
- 18. Значення у побуті
- 20. Скачать презентацию















 Физические свойства минералов
Физические свойства минералов Дифузія у побуті
Дифузія у побуті Путешествие в мир химии познавательная игра по химии, 8 класс Автор: Лаврентьева Снежана Павловна, учитель химии и биологии
Путешествие в мир химии познавательная игра по химии, 8 класс Автор: Лаврентьева Снежана Павловна, учитель химии и биологии  Скорость химических реакций Разработка урока по химии 11 класс
Скорость химических реакций Разработка урока по химии 11 класс Физико – химические характеристики электротехнических материалов
Физико – химические характеристики электротехнических материалов Сера и её соединения
Сера и её соединения Кислородсодержащие. Углеводы. Подготовка к ЕГЭ
Кислородсодержащие. Углеводы. Подготовка к ЕГЭ Реакции ионного обмена
Реакции ионного обмена Презентация по Химии "Особенности металла" - скачать смотреть
Презентация по Химии "Особенности металла" - скачать смотреть  Группа нефелиновых сиенитов-фонолитов
Группа нефелиновых сиенитов-фонолитов Строение атома. Периодический закон Д.И.Менделеева в свете теории строения атома. Цели урока: Обобщение и углубление знания о стро
Строение атома. Периодический закон Д.И.Менделеева в свете теории строения атома. Цели урока: Обобщение и углубление знания о стро Наука химия. Роль химии в промышленности
Наука химия. Роль химии в промышленности Соединения терпеноидной структуры. Тема № 3
Соединения терпеноидной структуры. Тема № 3 Окислительно-восстановительные процессы
Окислительно-восстановительные процессы Биоэнергетика. Часть первая
Биоэнергетика. Часть первая ГБОУ СОШ с. Тимофеевка Учитель химии и биологии: Солонцова Наталья Леонидовна
ГБОУ СОШ с. Тимофеевка Учитель химии и биологии: Солонцова Наталья Леонидовна  The law of mass conservation
The law of mass conservation Предпрофильный курс Мир химии
Предпрофильный курс Мир химии Металлы. Общая характеристика
Металлы. Общая характеристика Термодинамические характеристики многокомпонентных систем. Растворы. Основные понятия и определения
Термодинамические характеристики многокомпонентных систем. Растворы. Основные понятия и определения Основы общей химии
Основы общей химии Підготувала Учениця 11 класу Лемак Андріана
Підготувала Учениця 11 класу Лемак Андріана  Ионообменная хроматография и ее применение
Ионообменная хроматография и ее применение Агрохимия растений
Агрохимия растений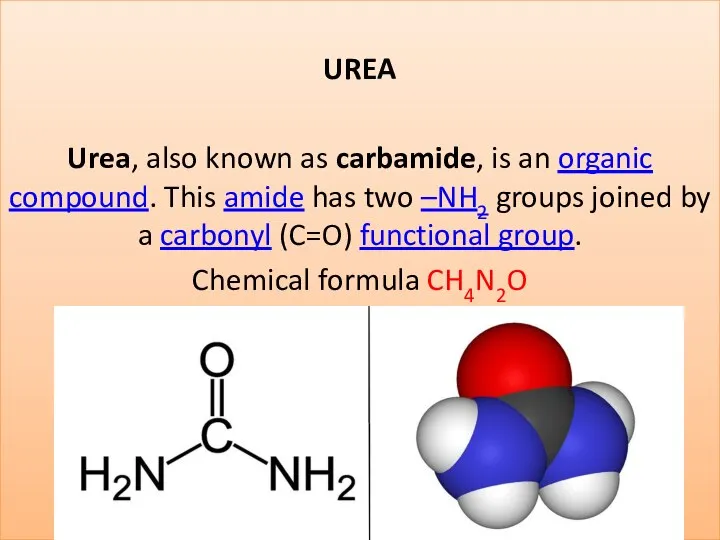 Urea (carbamide)
Urea (carbamide) Химия в строительстве
Химия в строительстве ИК-спектроскопия органических соединений
ИК-спектроскопия органических соединений Физико-химические методы исследования и техника лабораторных работ
Физико-химические методы исследования и техника лабораторных работ