Содержание
- 2. Цель проекта изучить процесс коррозии металлов в различных средах на примере железа.
- 3. Задачи Изучить литературу и другие источники информации по теме исследования 2. Определить экспериментальным путём влияние различных
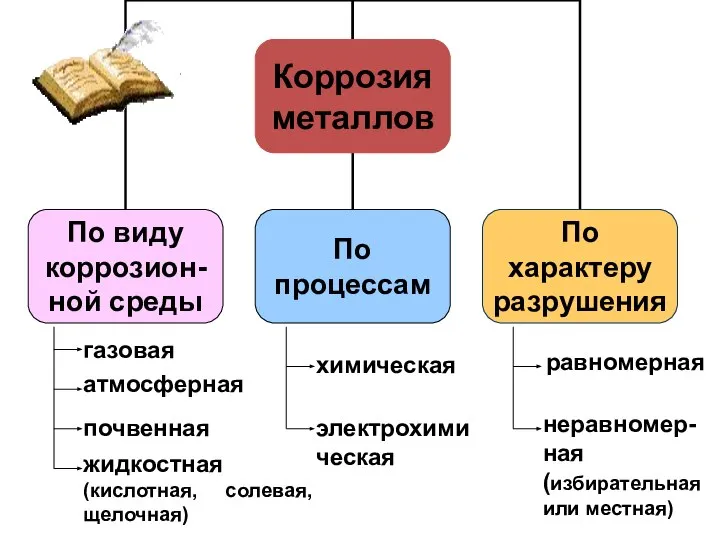
- 4. Содержание Введение 1. Литературный обзор. 1.1. Понятие коррозии 1.2. Классификация коррозионных процессов. 1.2.1. По типу разрушений.
- 5. Понятие коррозии. Коррозия (от лат. corrosio — разъедание) — это самопроизвольное разрушение металлов в результате химического
- 6. газовая атмосферная почвенная жидкостная (кислотная, солевая, щелочная) химическая электрохимическая равномерная неравномер- ная (избирательная или местная)
- 7. Коррозия металла. Ржавчина, самый распространенный вид коррозии.
- 8. Учёные, занимавшиеся изучением процессов коррозии. Якоби Б.С.-открытие гальванопластики. Бекетов Н.Н.-основоположник физической химии , академик Петербугской АН
- 9. Практическая часть Для исследования было взято 7 железных пластинок примерно одинакового размера и формы.
- 10. Все пластинки были помещены в стаканы с различной средой: 1.Вода 2.Слабый раствор KOH 3. Слабый раствор
- 11. Результаты 1. Водный раствор
- 12. Результаты 2.Слабый щелочной раствор
- 13. Результаты 3. Раствор фосфорной кислоты
- 14. Результаты 4. Раствор фосфорной кислоты более концентрированый
- 15. Результаты 5.Раствор поваренной соли
- 16. Результаты опытов 6.Слабокислый раствор соляной кислоты
- 17. Выводы Результаты исследования показали, что самой агрессивной средой для железа стала вода, раствор соляной кислоты и
- 18. Необходимость осуществления мероприятий по защите от коррозии диктуется тем обстоятельством, что потери от коррозии приносят чрезвычайно
- 19. СПОСОБЫ ЗАЩИТЫ ОТ КОРРОЗИИ Нанесение защитных покрытий (лаки, краски, эмали); Покрытие другим металлом (позолота, серебрение, хромирование,
- 20. Классификация коррозионных процессов. По типу разрушений. По типу разрушений коррозия бывает сплошной и местной. При равномерном
- 21. Химическая коррозия: Химическая коррозия: Химическая коррозия — взаимодействие поверхности металла с (коррозионно-активной) средой, В этом случае
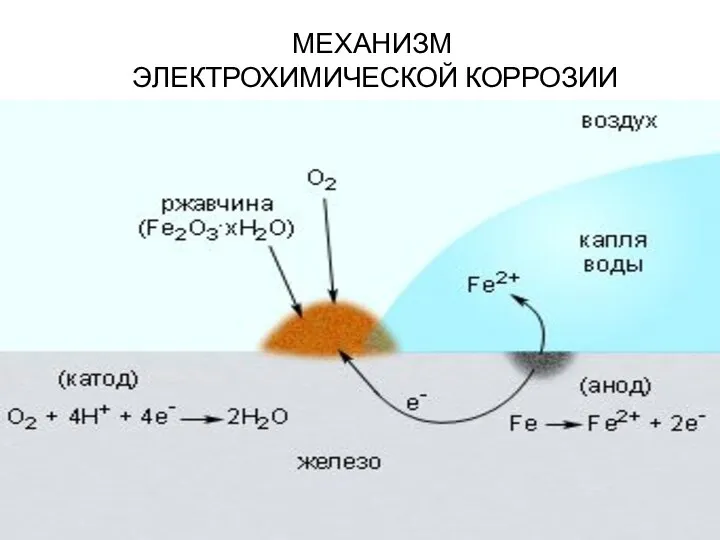
- 22. МЕХАНИЗМ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
- 23. Электрохимическая коррозия: Разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов называют электрохимической коррозией. В
- 24. Особенно разнообразные процессы химической коррозии встречаются в различных химических производствах. В атмосфере водорода, метана и других
- 25. Водородная и кислородная коррозия Если происходит восстановление ионов H3O+ или молекул воды H2O, говорят о водородной
- 27. Скачать презентацию






















 Классификация химических реакций
Классификация химических реакций Галогены
Галогены Сложные эфиры в природе и их применение
Сложные эфиры в природе и их применение Презентация для класса Способы получения натрия
Презентация для класса Способы получения натрия  Углеводы. Общие представления об углеводах
Углеводы. Общие представления об углеводах Скандий
Скандий Сульфаты. Лекция 13
Сульфаты. Лекция 13 Презентация по Химии "Аммиак: состав, строение, свойства, применение" - скачать смотреть
Презентация по Химии "Аммиак: состав, строение, свойства, применение" - скачать смотреть  Водород.Способы получения. Физические свойства
Водород.Способы получения. Физические свойства Текстильные волокна
Текстильные волокна  Растворы, классификация растворов
Растворы, классификация растворов Способы определения УЭС пластовой воды
Способы определения УЭС пластовой воды Бионеорганическая химия. Биогенные элементы. (Лекция 5.2)
Бионеорганическая химия. Биогенные элементы. (Лекция 5.2) Металлические сплавы
Металлические сплавы Неон. Получение
Неон. Получение Алканы. Строение. Изомерия и номенклатура
Алканы. Строение. Изомерия и номенклатура Мас-спектр кластерів вуглецю
Мас-спектр кластерів вуглецю Жиры (триглицериды)
Жиры (триглицериды) Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов
Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов Горение жидкостей
Горение жидкостей Ph воды
Ph воды Алканы и их свойства
Алканы и их свойства Мышьяк (лат. аrsenicum)
Мышьяк (лат. аrsenicum) «Широко распростирает химия руки свои в дела человеческие! «Широко распростирает химия руки свои в дела человеческие! Куда ни
«Широко распростирает химия руки свои в дела человеческие! «Широко распростирает химия руки свои в дела человеческие! Куда ни Непредельные углеводороды: этилен
Непредельные углеводороды: этилен Живая химия
Живая химия Вторая группа главная подгруппа наряду с семейством щелочноземельных металлов включает и два типических элемента –бериллий
Вторая группа главная подгруппа наряду с семейством щелочноземельных металлов включает и два типических элемента –бериллий  Сухой спирт
Сухой спирт