Содержание
- 2. Сульфатна кислота утворює солі двох типів: кислі та середні сульфати СаSO4, Na2SO4 середні Солі сульфатної кислоти
- 4. Формула натрій лауретсульфату За здатністю до піноутворення конкурентів у натрій лауретсульфату нема до цього часу. Поверхнево-активна
- 5. Правила безпеки праці при виконанні лабораторної роботи Працюйте в кабінеті хімії обов’язково в халаті. При виконанні
- 6. Дано: Розв’язання m(Na) = 9,2 г 1. З’ясовуємо, чи повністю вступить у реакцію кожна m(Cl2) =
- 7. 2. Масу продукту реакції знаходимо за речовиною, яка в недостачі: у= = 23,4 г – m(NaCl).
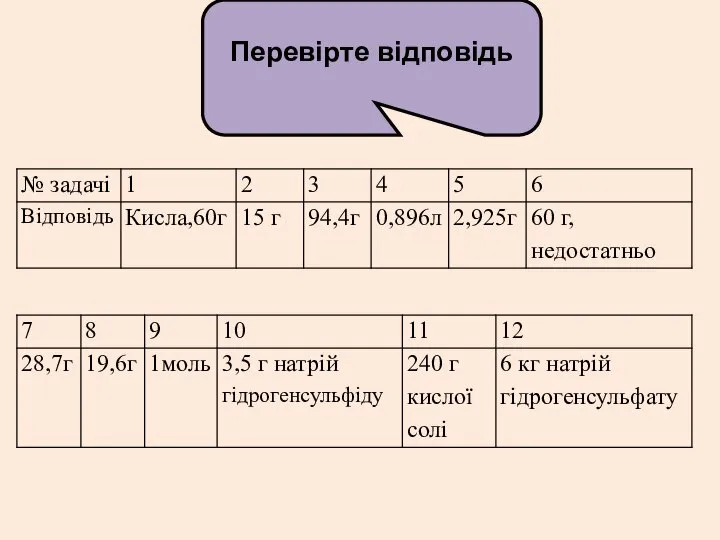
- 8. Перевірте відповідь
- 10. Скачать презентацию
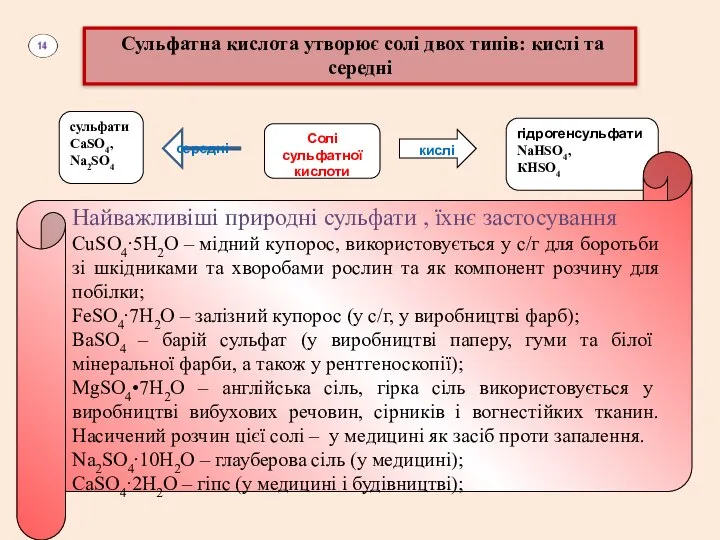
Сульфатна кислота утворює солі двох типів: кислі та середні
сульфати
СаSO4, Na2SO4
середні
Солі
Сульфатна кислота утворює солі двох типів: кислі та середні
сульфати
СаSO4, Na2SO4
середні
Солі
кислі
гідрогенсульфати
NaHSO4,
КHSO4
Найважливіші природні сульфати , їхнє застосування
СuSO4∙5Н2O – мідний купорос, використовується у с/г для боротьби зі шкідниками та хворобами рослин та як компонент розчину для побілки;
FeSO4∙7Н2O – залізний купорос (у с/г, у виробництві фарб);
ВаSO4 – барій сульфат (у виробництві паперу, гуми та білої мінеральної фарби, а також у рентгеноскопії);
MgSO4•7H2O – англійська сіль, гірка сіль використовується у виробництві вибухових речовин, сірників і вогнестійких тканин. Насичений розчин цієї солі – у медицині як засіб проти запалення.
Na2SO4∙10Н2O – глауберова сіль (у медицині);
СаSO4∙2Н2O – гіпс (у медицині і будівництві);
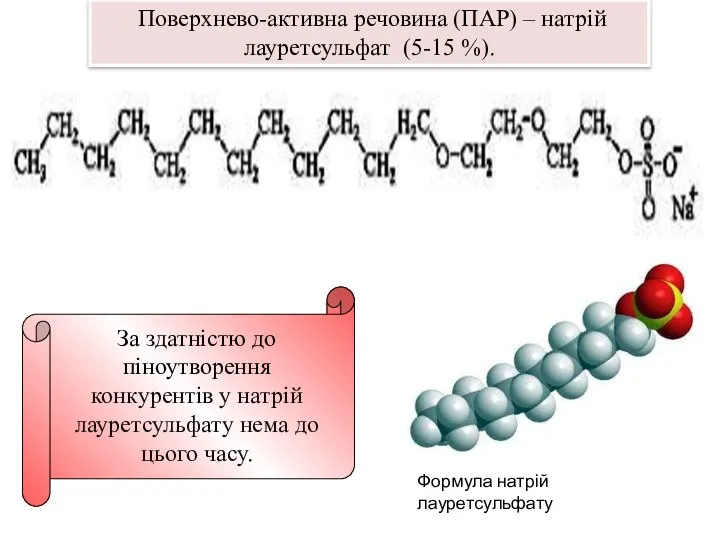
Формула натрій лауретсульфату
За здатністю до піноутворення конкурентів у натрій лауретсульфату
Формула натрій лауретсульфату
За здатністю до піноутворення конкурентів у натрій лауретсульфату
Поверхнево-активна речовина (ПАР) – натрій лауретсульфат (5-15 %).
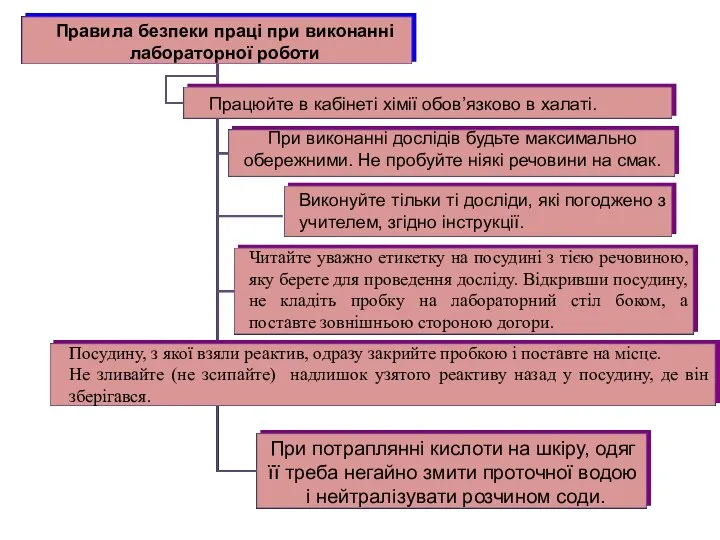
Правила безпеки праці при виконанні лабораторної роботи
Працюйте в кабінеті хімії обов’язково
Правила безпеки праці при виконанні лабораторної роботи
Працюйте в кабінеті хімії обов’язково
При виконанні дослідів будьте максимально обережними. Не пробуйте ніякі речовини на смак.
Виконуйте тільки ті досліди, які погоджено з учителем, згідно інструкції.
Читайте уважно етикетку на посудині з тією речовиною, яку берете для проведення досліду. Відкривши посудину, не кладіть пробку на лабораторний стіл боком, а поставте зовнішньою стороною догори.
Посудину, з якої взяли реактив, одразу закрийте пробкою і поставте на місце.
Не зливайте (не зсипайте) надлишок узятого реактиву назад у посудину, де він зберігався.
При потраплянні кислоти на шкіру, одяг
її треба негайно змити проточної водою
і нейтралізувати розчином соди.
Дано: Розв’язання
m(Na) = 9,2 г 1. З’ясовуємо, чи повністю вступить у
Дано: Розв’язання
m(Na) = 9,2 г 1. З’ясовуємо, чи повністю вступить у
m(Cl2) = 35,5 г тобто, яка речовина в недостачі, а яка у надлишку.
m(NaCl) — ? Визначаємо кількості речовини натрію і хлору:
m (Na) 9,2 г
n(Na) = ————= —————= 0,4 моль;
M(Na) 23 г/моль
m(Cl2) 35,5 г
n(Cl2) = ————= —————= 0,5 моль.
M(Cl2 ) 71 г/моль
Згідно з хімічним рівнянням
Х моль
0,4моль 0,5моль у г
2Na + Cl2 = 2NaCl
2 моль 1моль 2моль
58,5 г/моль
117 г
Х= = 0,2 моль - n(СІ2, яка
потрібна для реакції з 0,4моль Na). А є 0,5 моль СІ2.
Отже СІ2 – в надлишку, а Na – в недостачі.
речовина,
2. Масу продукту реакції знаходимо за речовиною, яка в
недостачі:
2. Масу продукту реакції знаходимо за речовиною, яка в
недостачі:
у=
= 23,4 г – m(NaCl).
0,4моль 0,5моль у г
2Na + Cl2 = 2NaCl
2 моль 1моль 2моль
58,5 г/моль
117 г
;
ДОМАШНЄ ЗАВДАННЯ:
питання вивчити - §9;
,
ст. 71 №85- 87, ст. 54 №62-65 виконати у домашньому зошиті.
Перевірте відповідь
Перевірте відповідь


 Квест с Гарри Поттером
Квест с Гарри Поттером Мило. Мийні засоби
Мило. Мийні засоби Презентация по Химии "Первоначальные химические понятия" - скачать смотреть
Презентация по Химии "Первоначальные химические понятия" - скачать смотреть  Структура периодической системы элементов
Структура периодической системы элементов Теория создание стекла, оптические кристаллы
Теория создание стекла, оптические кристаллы Композиты. Полимерные композиционные материалы
Композиты. Полимерные композиционные материалы Альдегиды
Альдегиды Металлические сплавы
Металлические сплавы Минералы
Минералы Генетическая связь веществ. Виды реакций
Генетическая связь веществ. Виды реакций Путешествие в мир химии познавательная игра по химии, 8 класс Автор: Лаврентьева Снежана Павловна, учитель химии и биологии
Путешествие в мир химии познавательная игра по химии, 8 класс Автор: Лаврентьева Снежана Павловна, учитель химии и биологии  Гормоны. Виды и классификация гормонов
Гормоны. Виды и классификация гормонов Хлор
Хлор Излучение и поглощение света атомами. Виды спектров, спектральный анализ
Излучение и поглощение света атомами. Виды спектров, спектральный анализ Нефть. Свойства нефти
Нефть. Свойства нефти Алкины
Алкины Влияние нанокомпозитов платина/Нафион на электрокаталитическую активность реакции восстановления водорода и окисления кислород
Влияние нанокомпозитов платина/Нафион на электрокаталитическую активность реакции восстановления водорода и окисления кислород Методы экстрагирования ЛРС и оборудование
Методы экстрагирования ЛРС и оборудование Технология производства химических волокон. Свойства химических волокон. 7 класс
Технология производства химических волокон. Свойства химических волокон. 7 класс Біохімічний склад кормів - первинний показник їх технологічної й продуктивної можливості
Біохімічний склад кормів - первинний показник їх технологічної й продуктивної можливості Физико-химические методы анализа
Физико-химические методы анализа Введение в органическую химию
Введение в органическую химию Возможные роли АФК в старении
Возможные роли АФК в старении Химические свойства оксидов
Химические свойства оксидов Амины. Номенклатура аминов
Амины. Номенклатура аминов Vodík
Vodík History of radioactivity
History of radioactivity История появления новогодней открытки
История появления новогодней открытки