Содержание
- 2. Металлы Металлы – это элементы, атомы которых легко отдают электроны внешнего (а некоторые и предвнешнего) электронного
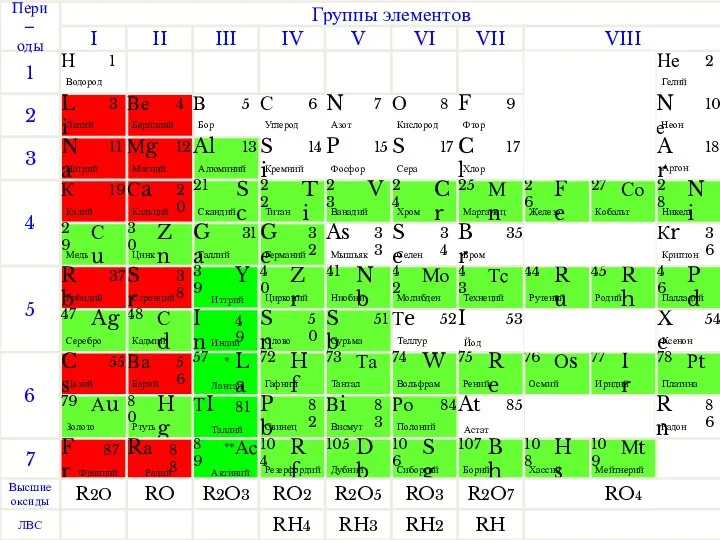
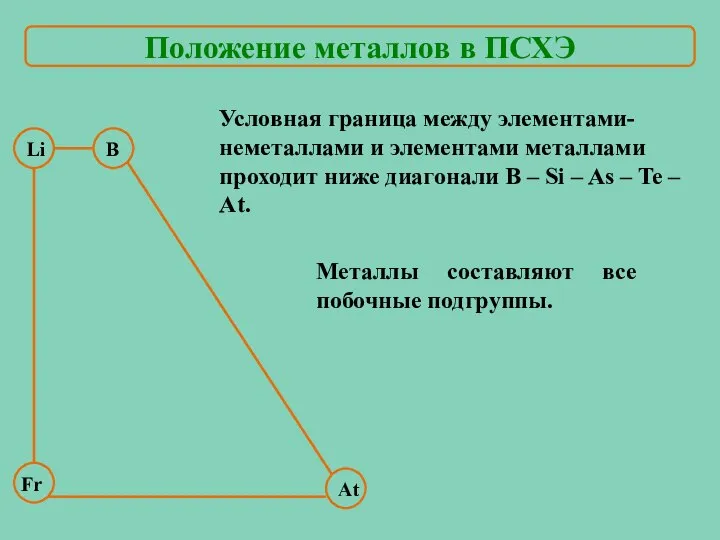
- 4. В At Условная граница между элементами-неметаллами и элементами металлами проходит ниже диагонали B – Si –
- 5. В атомах металлов на внешнем электронном слое небольшое число электронов Атомы металлов отдают валентные электроны, превращаясь
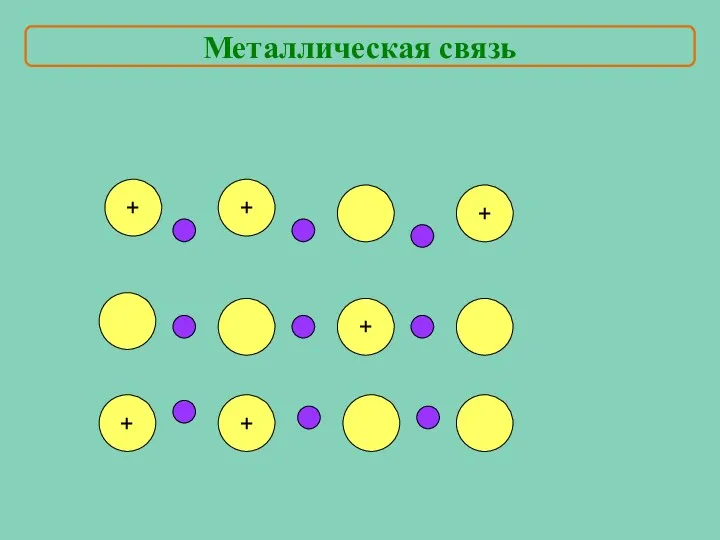
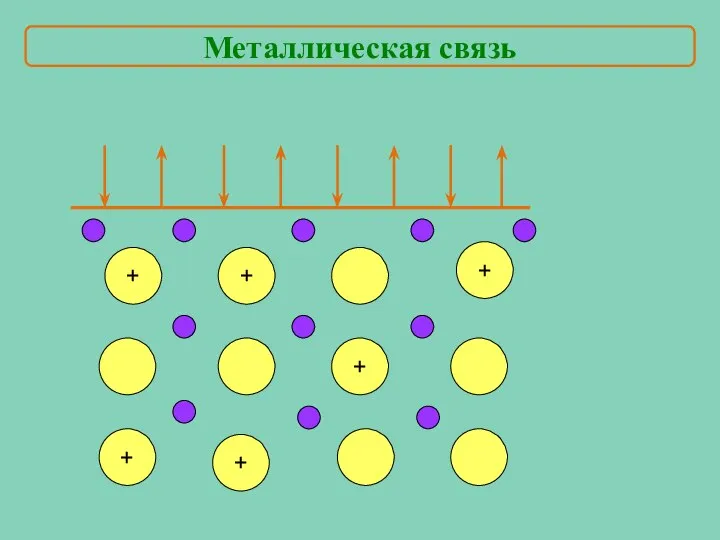
- 6. + + + + + + Металлическая связь
- 7. электропроводность теплопроводность Почему металлы проводят электрический ток и тепло? Физические свойства металлов
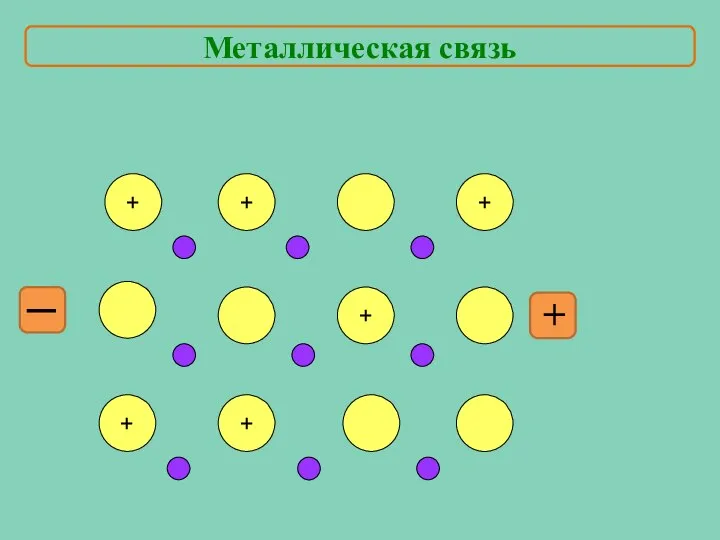
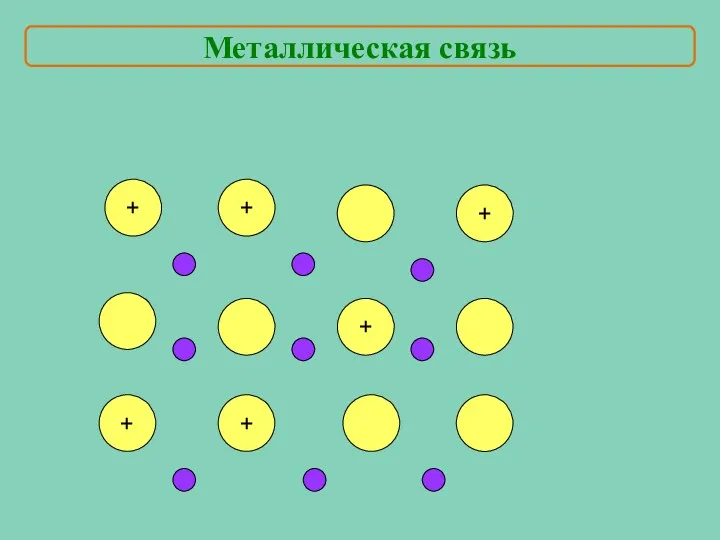
- 8. + + + + + + ─ + Металлическая связь
- 9. Физические свойства металлов
- 10. Почему металлы блестят? Металлы обладают металлическим блеском Физические свойства металлов
- 11. + + + + + + Металлическая связь
- 12. Физические свойства металлов
- 13. Почему металлы гнутся? Металлы ковки и пластичны Физические свойства металлов
- 14. + Металлическая связь
- 15. Физические свойства металлов
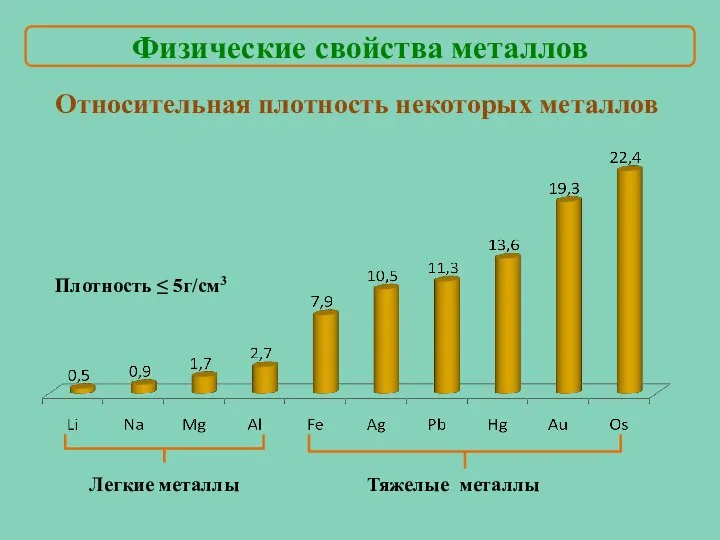
- 16. Относительная плотность некоторых металлов Легкие металлы Тяжелые металлы Плотность ≤ 5г/см3 Физические свойства металлов
- 17. Физические свойства металлов
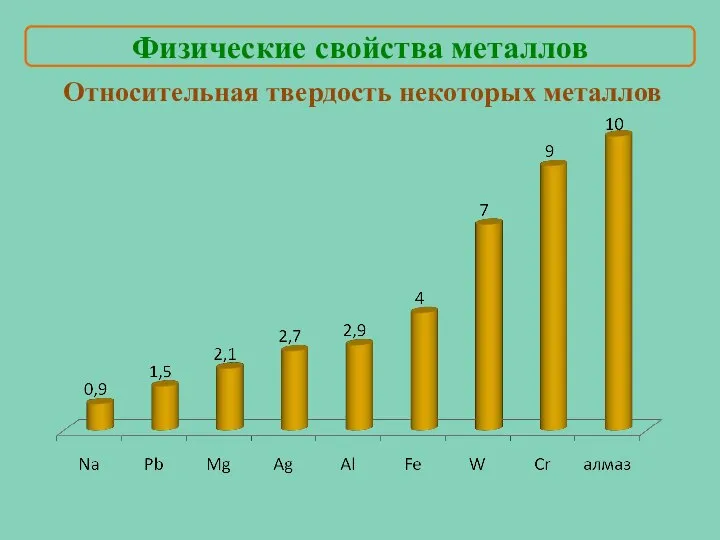
- 18. Относительная твердость некоторых металлов Физические свойства металлов
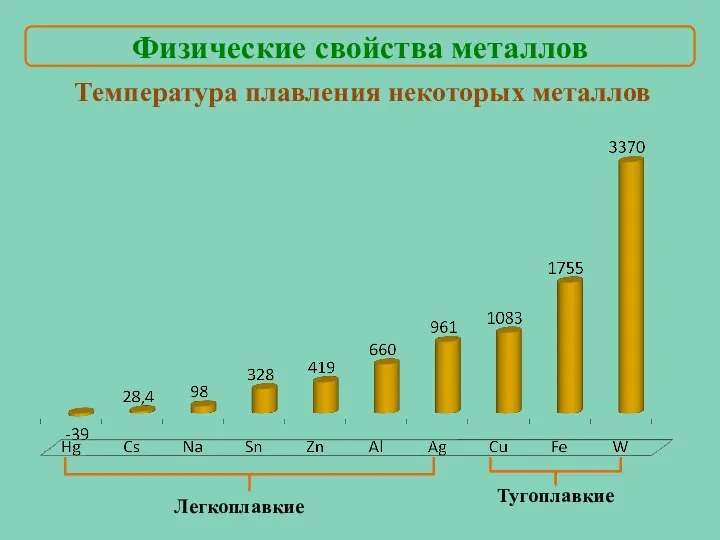
- 19. Температура плавления некоторых металлов Легкоплавкие Тугоплавкие Физические свойства металлов
- 20. Физические свойства металлов
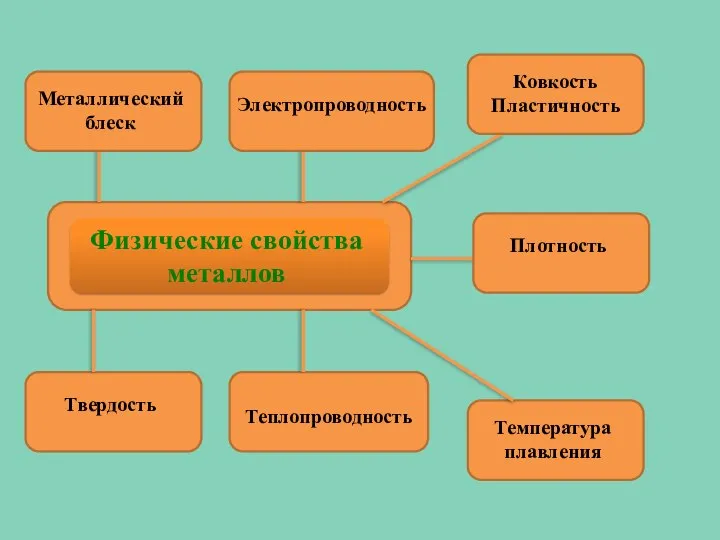
- 21. Металлический блеск Электропроводность Теплопроводность Твердость Плотность Ковкость Пластичность Температура плавления Физические свойства металлов
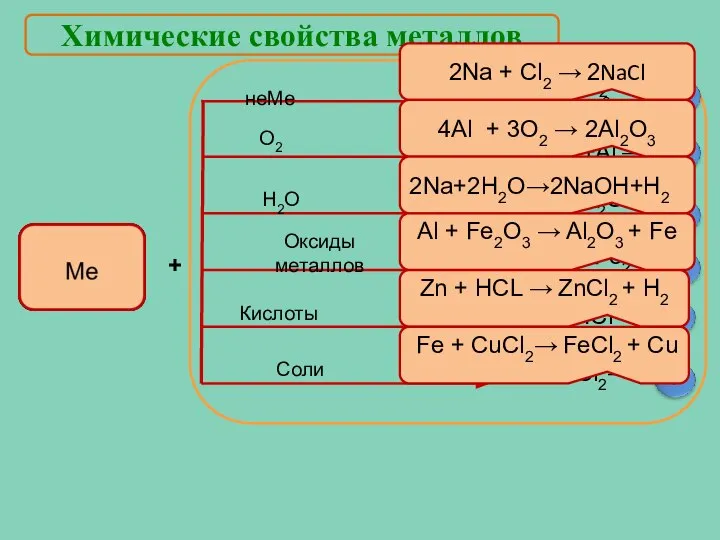
- 22. Химические свойства металлов + 2Na + Cl2 → 2NaCl 4Al + 3O2 → 2Al2O3 2Na+2Н2О→2NaOH+H2 Al
- 23. Особенности химических реакций металлов:
- 24. Взаимодействие металлов с кислотами M + HmAc → MxAcy + H2↑
- 25. Взаимодействие металлов с растворами солей M + M/xAcy → MxAcy + М/
- 26. Общие способы получения металлов Пирометаллургия – получение металлов и сплавов под действием высоких температур. Гидрометаллургия –
- 27. Общие способы получения металлов Пирометаллургия Восстановление углем (угарным газом): 2PbO + C = CO2 + 2Pb
- 28. Общие способы получения металлов Гидрометаллургия 1 стадия: растворение в кислоте нерастворимых минералов, содержащих металлы: CuS +
- 29. Общие способы получения металлов Электрометаллургия Электролиз расплавов: KCl → K+ + Cl─ катод (─) K+ +1e
- 30. Химическая Электрохимическая 4Fe + 6H2O + 3O2 = 4Fe(OH)3 Коррозия железа и образование ржавчины Коррозия железа
- 31. Защита более активным металлом; Отделение металла от агрессивной среды; Использование замедлителей коррозии; Электрозащита; Пассивация металлов; Изготовление
- 33. Скачать презентацию


















 Алкены. Свойства. 10 класс
Алкены. Свойства. 10 класс Химические реакции спиртов
Химические реакции спиртов Золь-гель технология. Прорыв XXI века
Золь-гель технология. Прорыв XXI века Показники якості води Онуфреїв Оленка Слухач МАН Секція біологія.
Показники якості води Онуфреїв Оленка Слухач МАН Секція біологія. Химические волокна
Химические волокна Применение s-, p-, d- элементов в медицине
Применение s-, p-, d- элементов в медицине Оксиды углерода
Оксиды углерода Химические свойства оксидов. Тренажер
Химические свойства оксидов. Тренажер От монументов до безделушек
От монументов до безделушек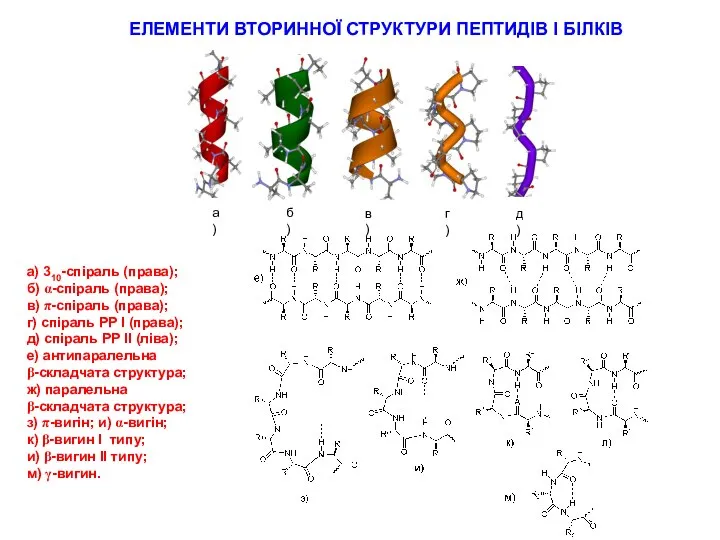 Елементи вторинної структури пептидів і білків
Елементи вторинної структури пептидів і білків Алюміній
Алюміній  Азотная кислота и ее соли - нитраты
Азотная кислота и ее соли - нитраты Періодична система хімічних елементів
Періодична система хімічних елементів Презентация по химии ПЕПТИДЫ и Белки
Презентация по химии ПЕПТИДЫ и Белки  Обобщающий урок по теме «Неметаллы» 9 класс
Обобщающий урок по теме «Неметаллы» 9 класс Теория теплового воспламенения газовых смесей
Теория теплового воспламенения газовых смесей Сырьевая база парфюмерно-косметической промышленности
Сырьевая база парфюмерно-косметической промышленности Кинетика химических реакций. (Лекция 12)
Кинетика химических реакций. (Лекция 12) Неорганические полимеры
Неорганические полимеры VB, VIB и VIIB подгруппы ПС: элементы подгрупп ванадия, хрома и марганца
VB, VIB и VIIB подгруппы ПС: элементы подгрупп ванадия, хрома и марганца Сера. Аллотропия серы. Физические и химические свойства серы. Применение
Сера. Аллотропия серы. Физические и химические свойства серы. Применение Мұнайдың құрамындағы тұз мөлшерін анықтау
Мұнайдың құрамындағы тұз мөлшерін анықтау Всероссийская олимпиада школьников по химии. Отборочный (районный) этап. Практический тур
Всероссийская олимпиада школьников по химии. Отборочный (районный) этап. Практический тур Косметические средства. Виды, состав и влияние на организм
Косметические средства. Виды, состав и влияние на организм 8 шагов к кристаллу
8 шагов к кристаллу Химиялық байланыс және заттардың құрылымдық түрлі сатылары
Химиялық байланыс және заттардың құрылымдық түрлі сатылары Аттестационная работа. Способ формирования метапредметных результатов обучения при обучении химии в условиях реализации ФГОС
Аттестационная работа. Способ формирования метапредметных результатов обучения при обучении химии в условиях реализации ФГОС Ацетилен. Физические и химические свойства
Ацетилен. Физические и химические свойства