Содержание
- 2. Його назва походить від латинського слова,що в перекладі на нашу-галун,назва подвійної солі,до складу якої входить алюміній
- 4. Поширеність в природі Алюміній-третій елемент за поширенням у природі після Оксигену і Силіцію:його атомна частка в
- 5. Боксит Нефелін Кріоліт Каолініт Польовий шпат
- 6. Фізичні властивості Алюмінію: Алюміній – сріблясто-білий метал, легкий і пластичний, густина його = 2,7 г/см3, температура
- 7. Хімічні властивості лужних металів. Взаємодія з неметалами: 1) З киснем: 4Аl + 3О2 = 2Аl2О3 2)
- 8. Алюміній оксид Аl 2O3 Проявляє амфотерні властивості: Аl2O3 +6 НС1 = 2АlСl3 + 3Н2О Аl 2O3
- 9. Алюміній гідроксид Al(OH)3 Проявляє амфотерні властивості: Аl (OH)3 + 3НС1 = АlСl3 + 3Н2О Аl (OH)3
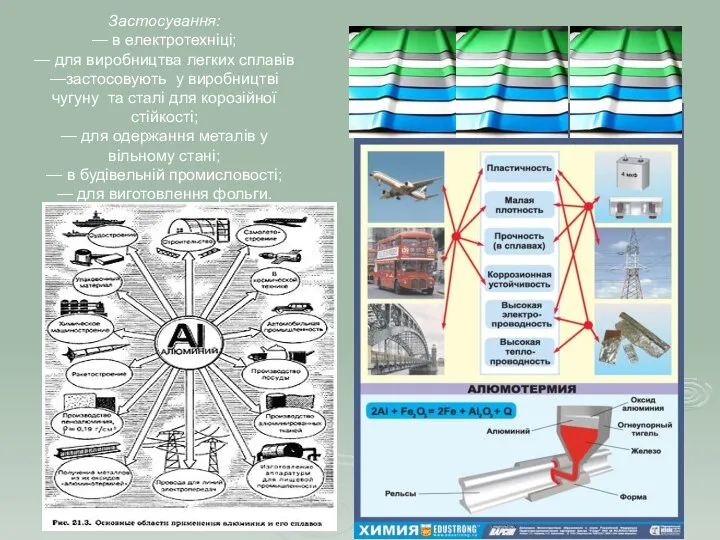
- 10. Застосування: — в електротехніці; — для виробництва легких сплавів —застосовують у виробництві чугуну та сталі для
- 12. Скачать презентацию








 Ди- және полисахаридтер
Ди- және полисахаридтер Элементы химической кинетики
Элементы химической кинетики Круговорот азота в природе
Круговорот азота в природе Биогеохимические функции и принципы живого вещества
Биогеохимические функции и принципы живого вещества Гетероциклические соединения
Гетероциклические соединения Фотолабораторный процесс. Основные этапы фото обработки. Рентгеновского изображения
Фотолабораторный процесс. Основные этапы фото обработки. Рентгеновского изображения Презентация по Химии "Презентация по химии Галогены" - скачать смотреть
Презентация по Химии "Презентация по химии Галогены" - скачать смотреть  Химические свойства насыщенных углеводородов
Химические свойства насыщенных углеводородов Валентность связи и локальный баланс валентности
Валентность связи и локальный баланс валентности Химиялық элементтердің тірі және өлі табиғатта таралуы
Химиялық элементтердің тірі және өлі табиғатта таралуы Процессы коксования
Процессы коксования Алканы
Алканы Основные химические понятия
Основные химические понятия Спирты, они же – алкоголи. В средние века люди считали этиловый спирт одним из сильнейших лекарственных средств и поэтому назвали
Спирты, они же – алкоголи. В средние века люди считали этиловый спирт одним из сильнейших лекарственных средств и поэтому назвали  Стекло. История стекла. Свойства стекла
Стекло. История стекла. Свойства стекла Термодинамические функции газовых смесей. Идеальные растворы. Закон Рауля
Термодинамические функции газовых смесей. Идеальные растворы. Закон Рауля Гетероциклы. Гетероциклические соединения
Гетероциклы. Гетероциклические соединения Презентация КРИСТАЛЛЫ
Презентация КРИСТАЛЛЫ  Аттестационная работа. Образовательная программа элективного курса по химии
Аттестационная работа. Образовательная программа элективного курса по химии Коллоидная химия
Коллоидная химия Полисахаридтер – жоғары молекулалық көмірсулар
Полисахаридтер – жоғары молекулалық көмірсулар Мінеральні добрива
Мінеральні добрива  Материаловедение. Теория сплавов
Материаловедение. Теория сплавов Презентация по химии Органические вещества
Презентация по химии Органические вещества  Этанол. Одноатомный спирт
Этанол. Одноатомный спирт Актуальні питання і перспективи створення вікових ліків в Україні
Актуальні питання і перспективи створення вікових ліків в Україні Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Procesul zaharului
Procesul zaharului