Содержание
- 2. План Визначення. Загальна характеристика. Історія відкриття: Тріади Деберайнера; Земна модель Шанкуртуа; Закон Октав; Дмитро Менделєєв та
- 3. Періодична система елементів — класифікація хімічних елементів, розроблена на основі періодичного закону. Визначення терміну
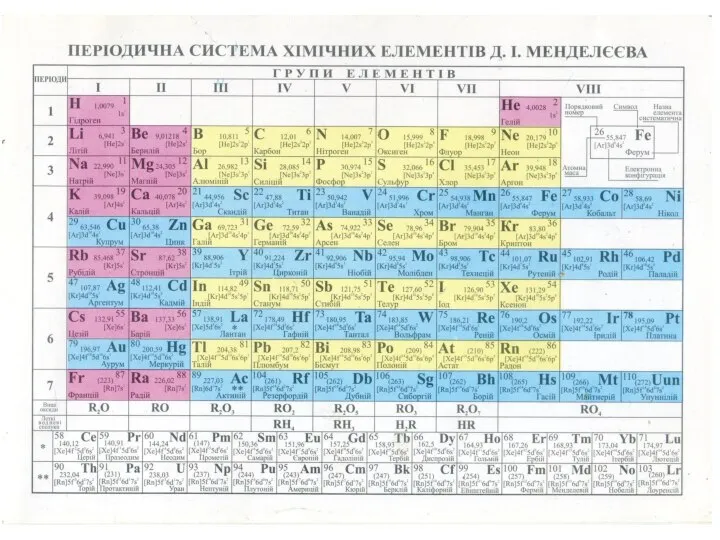
- 5. Впорядковане за зростанням атомного номера розташування елементів у вигляді таблиці. У комірках періодичної таблиці розміщено інформацію,
- 6. Перший перелік хімічних елементів склав в 1789 р. французький хімік А. Л. Лавуазьє. До цього списку
- 7. До середини XIX століття були відкриті 63 хімічні елементи, і спроби знайти закономірності в цьому наборі
- 8. Йоганн Вольфганг Деберейнер
- 9. Як хімік Шанкуртуа відомий тим, що у 1862 запропонував систематизацію хімічних елементів, основану на закономірний зміні
- 10. Олександр Еміль Бегуйе де Шанкуртуа
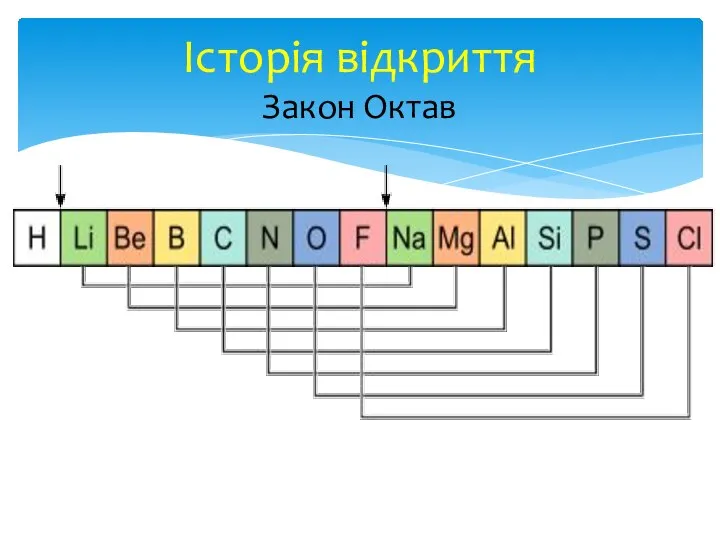
- 11. У 1864 р. свій варіант періодичної системи запропонував хімік і музикант Джон Ньюлендс. За запропонованим ним
- 12. Джон Ньюлендс
- 13. Історія відкриття Закон Октав
- 14. У цьому ж десятилітті з'явилося ще кілька спроб систематизації хімічних елементів; ближче всього до остаточного варіанту
- 15. Сутність відкриття Менделєєва полягала у тому, що зі зростанням атомної маси хімічних елементів їхні властивості змінюються
- 16. Оригінальний вигляд періодичної системи елементів за Менделеєвим, 1869 рік
- 17. Лотар Юліус Майєр
- 18. Дмитро Іванович Менделєєв
- 19. У 1913 році Генрі Мозлі встановив залежність частоти та довжини хвилі серій характеристичного рентгенівського випромінювання від
- 20. Генрі Мозлі
- 21. Найпоширенішими з усіх є 3 форми таблиці Періодичної системи елементів: «коротка» (короткоперіодна), «довга» (довгоперіодна) і «наддовга».
- 22. На основі періодичності властивостей у періодичній системі елементи формують у групи, періоди або блоки. Структура періодичної
- 23. Група — один із стовпців періодичної таблиці. Для груп, зазвичай, характерними є краще виражені періодичні тенденції,
- 24. Період відповідає рядку періодичної таблиці. Хоча для груп, як вказувалось вище, характернми є суттєвіші тенденції і
- 25. У зв'язку із значимістю зовнішньої електронної оболонки атома різні області періодичної таблиці іноді описуються як блоки,
- 26. Блокова діаграма періодичної таблиці
- 27. Періодична система стала важливою віхою у розвитку атомно-молекулярного вчення. Завдяки їй склалося сучасне поняття про хімічний
- 29. Скачать презентацию
План
Визначення.
Загальна характеристика.
Історія відкриття:
Тріади Деберайнера;
Земна модель Шанкуртуа;
Закон Октав;
Дмитро
План
Визначення.
Загальна характеристика.
Історія відкриття:
Тріади Деберайнера;
Земна модель Шанкуртуа;
Закон Октав;
Дмитро
Генрі Мозлі.
Форми Періодичної системи елементів.
Структура періодичної системи.
Значення Періодичної системи.
Мета: ознайомлення з історією створення періодичної системи
Періодична система елементів — класифікація хімічних елементів, розроблена на основі періодичного
Періодична система елементів — класифікація хімічних елементів, розроблена на основі періодичного
Визначення терміну
Впорядковане за зростанням атомного номера розташування елементів у вигляді таблиці. У
Впорядковане за зростанням атомного номера розташування елементів у вигляді таблиці. У
Загальна характеристика
Перший перелік хімічних елементів склав в 1789 р. французький хімік А.
Перший перелік хімічних елементів склав в 1789 р. французький хімік А.
Історія відкриття
До середини XIX століття були відкриті 63 хімічні елементи, і спроби
До середини XIX століття були відкриті 63 хімічні елементи, і спроби
Історія відкриття
Тріади Деберайнера
Йоганн Вольфганг Деберейнер
Йоганн Вольфганг Деберейнер
Як хімік Шанкуртуа відомий тим, що у 1862 запропонував систематизацію хімічних
Як хімік Шанкуртуа відомий тим, що у 1862 запропонував систематизацію хімічних
Історія відкриття
Земна модель Шанкуртуа
Олександр Еміль Бегуйе де Шанкуртуа
Олександр Еміль Бегуйе де Шанкуртуа
У 1864 р. свій варіант періодичної системи запропонував хімік і музикант
У 1864 р. свій варіант періодичної системи запропонував хімік і музикант
Історія відкриття
Закон Октав
Джон Ньюлендс
Джон Ньюлендс
Історія відкриття
Закон Октав
Історія відкриття
Закон Октав
У цьому ж десятилітті з'явилося ще кілька спроб систематизації хімічних елементів;
У цьому ж десятилітті з'явилося ще кілька спроб систематизації хімічних елементів;
Історія відкриття
Дмитро Менделєєв та Лотар Маєр
Сутність відкриття Менделєєва полягала у тому, що зі зростанням атомної маси
Сутність відкриття Менделєєва полягала у тому, що зі зростанням атомної маси
Історія відкриття
Дмитро Менделєєв та Лотар Маєр
Оригінальний вигляд періодичної системи елементів за Менделеєвим, 1869 рік
Оригінальний вигляд періодичної системи елементів за Менделеєвим, 1869 рік
Лотар Юліус Майєр
Лотар Юліус Майєр
Дмитро Іванович Менделєєв
Дмитро Іванович Менделєєв
У 1913 році Генрі Мозлі встановив залежність частоти та довжини хвилі
У 1913 році Генрі Мозлі встановив залежність частоти та довжини хвилі
Історія відкриття
Генрі Мозлі
Генрі Мозлі
Генрі Мозлі
Найпоширенішими з усіх є 3 форми таблиці Періодичної системи елементів: «коротка»
Найпоширенішими з усіх є 3 форми таблиці Періодичної системи елементів: «коротка»
Форми Періодичної системи елементів
На основі періодичності властивостей у періодичній системі елементи формують у групи,
На основі періодичності властивостей у періодичній системі елементи формують у групи,
Структура періодичної системи
Група — один із стовпців періодичної таблиці. Для груп, зазвичай, характерними
Група — один із стовпців періодичної таблиці. Для груп, зазвичай, характерними
Структура періодичної системи
Групи
Період відповідає рядку періодичної таблиці. Хоча для груп, як вказувалось вище,
Період відповідає рядку періодичної таблиці. Хоча для груп, як вказувалось вище,
Структура періодичної системи
Періоди
У зв'язку із значимістю зовнішньої електронної оболонки атома різні області періодичної
У зв'язку із значимістю зовнішньої електронної оболонки атома різні області періодичної
Структура періодичної системи
Блоки
Блокова діаграма періодичної таблиці
Блокова діаграма періодичної таблиці
Періодична система стала важливою віхою у розвитку атомно-молекулярного вчення. Завдяки їй
Періодична система стала важливою віхою у розвитку атомно-молекулярного вчення. Завдяки їй
Значення Періодичної системи
























 Алканы (предельные углеводороды)
Алканы (предельные углеводороды) Решение задач на вывод формул органических веществ относительно плотности
Решение задач на вывод формул органических веществ относительно плотности Презентация по Химии "Химическая эволюция. Эволюция биополимерных молекул. 10-й класс" - скачать смотреть
Презентация по Химии "Химическая эволюция. Эволюция биополимерных молекул. 10-й класс" - скачать смотреть  Хроматографічні методи
Хроматографічні методи Кислоты (часть 2). 8 класс
Кислоты (часть 2). 8 класс Этилен
Этилен Азот
Азот  Электростатические взаимодействия, как фактор, определяющий структуру и реакционную способность органических соединений
Электростатические взаимодействия, как фактор, определяющий структуру и реакционную способность органических соединений Токсины в быту. Классификация товаров бытовой химии
Токсины в быту. Классификация товаров бытовой химии Обобщающий урок по теме: Классы неорганических веществ
Обобщающий урок по теме: Классы неорганических веществ Углерод. Химические свойства
Углерод. Химические свойства Производство геля для душа и его состав
Производство геля для душа и его состав Вторая главная подгруппа ПС
Вторая главная подгруппа ПС History of radioactivity
History of radioactivity Химический состав клетки. Неорганические вещества клетки. Глава 1
Химический состав клетки. Неорганические вещества клетки. Глава 1 Тотықтырғыштар
Тотықтырғыштар Стекло, его происхождение и значение в жизни человека
Стекло, его происхождение и значение в жизни человека Аттестационная работа. Химические опыты с лекарственными веществами и лабораторный практикум
Аттестационная работа. Химические опыты с лекарственными веществами и лабораторный практикум Виникнення процесу горіння. Самозаймання речовин та матеріалів. Особливості самозаймання. Хімічне самозаймання. (Розділ 2.5.8)
Виникнення процесу горіння. Самозаймання речовин та матеріалів. Особливості самозаймання. Хімічне самозаймання. (Розділ 2.5.8) Промышленные аварии с выбросом опасных химических веществ
Промышленные аварии с выбросом опасных химических веществ Мило та його склад
Мило та його склад  Островные силикаты (Орто)
Островные силикаты (Орто) Применение закона действующих масс к окислительно-восстановительным равновесиям. (Лекция 6)
Применение закона действующих масс к окислительно-восстановительным равновесиям. (Лекция 6) Галогени. Хімічні властивості
Галогени. Хімічні властивості Общие сведения о комплексных соединениях
Общие сведения о комплексных соединениях Кислотность и основностьорганических соединений
Кислотность и основностьорганических соединений Фазовые диаграммы с протеканием 3-фазных реакций
Фазовые диаграммы с протеканием 3-фазных реакций Производные пролина (каптоприл, эналаприл) и фенилаланина (мелфалан). Требования к качеству и методы анализа
Производные пролина (каптоприл, эналаприл) и фенилаланина (мелфалан). Требования к качеству и методы анализа