Содержание
- 2. 1.Общая характеристика методов В основе лежат окислительно-восстановительные реакции. При помощи рабочих растворов окислителей определяют количественно содержание
- 3. Особенности окислительно-восстановительных реакций : 1) во многих реакциях кроме окислителей и восстановителей взаимодействуют и другие вещества
- 4. Реакции окисления — восстановления, на основе которых осуществляется количественный анализ, должны отвечать следующим требованиям: 1) реакция
- 5. Перманганатометрия –метод объемного анализа, в котором рабочим раствором является 0,1 М перманганат калия КМnО4. Перманганат калия
- 6. Перманганат калия КМn04 придает раствору малиновую окраску. В процессе титрования раствор сначала обесцвечивается, когда в растворе
- 7. В зависимости от среды при восстановлении КМn04 получаются различные конечные продукты. В кислой среде ионы Мn04-
- 8. Для стандартизации КMnО4 применяется щавелевая кислота Н2С204 х 2Н20 Процесс протекает по уравнению реакции: 5Н2С2О4 +
- 9. Молярная масса эквивалента рассчитыватся по формуле: МЭ(Х) = ƒэкв.(Х)М (Х) = М (Х)/Ζх, 126,07 МЭ(Н2С2О4) =
- 10. Перманганатометрию чаще всего применяют для анализа солей железа (II), кальция (в виде оксалата), щавелевой кислоты, меди
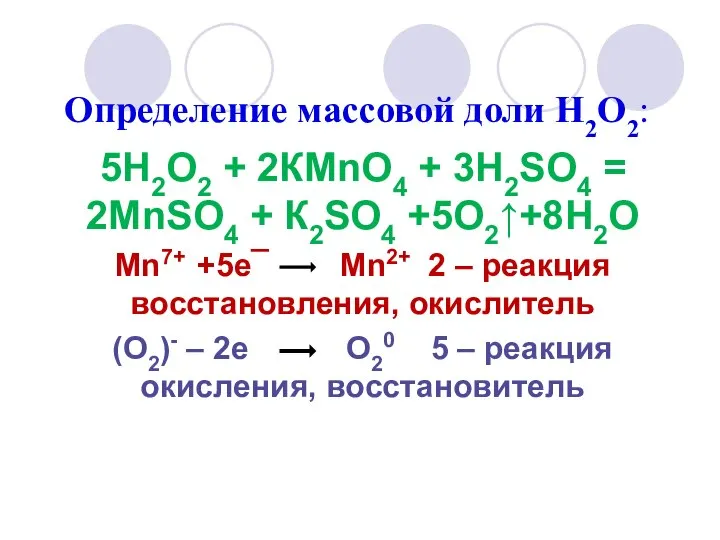
- 11. Определение массовой доли Н2О2: 5Н2О2 + 2КMnО4 + 3Н2SО4 = 2MnSО4 + К2SО4 +5О2↑+8Н2О Mn7+ +5е¯
- 12. Метод Йодометрии: относится к окислительно-восстановительным методам титрования, в ходе которых выделяется или расходуется свободный йод
- 13. В основе йодометрии лежат реакции: I20 + 2е- ---> 2 I- - окислитель или: 2I- -
- 14. Йодометрическое определение восстановителей проводят как прямым титрованием анализируемой пробы раствором йода, так и методом обратного титрования:
- 15. Стандартизацию 0,1 М раствора тиосульфата натрия проводят по дихромату калия При этом протекают следующие реакции: методом
- 16. Выделившийся свободный йод титруют раствором тиосульфата натрия: 2) 2Na2S203 + I2 = 2NaI + Na2S4O6. 2S2032-
- 17. Стандартизацию 0,1 М раствора йода проводят по стандартному раствору тиосульфата натрия при этом протекает реакция: 2Nа2S2О3
- 18. Индикатором в методе йодометрии служит раствор крахмала Это чувствительный и специфический индикатор, образующий с йодом адсорбционное
- 19. Определение восстановителей Из числа восстановителей этим методом чаще всего определяют сульфиты, сульфиды, хлорид олова (II) и
- 20. 2Nа2S2О3 + I2 = Nа2S4О6 + 2NаI 2 S2О32- - 2е- = S4О62- 1 – реакция
- 21. Броматометрия Броматометрический метод титрования основан на окислении восстановителей броматом калия, который в кислой среде является сильным
- 22. В качестве рабочего раствора применяют 0,1М раствор калия бромата КВrО3, который в кислой среде является одним
- 23. При титровании броматом первая лишняя капля бромата вступает в реакцию с получающимся в растворе бромидом, выделяя
- 24. Индикаторы в броматометрии При титровании применяют индикаторы например, метиловый красный или метиловый оранжевый. Эти индикаторы после
- 25. Броматометрию применяют для определения многих неорганических (мышьяка (III), сурьмы (III), таллия (I)) и органических соединений (
- 26. Преимущества броматометрического метода. 1. Можно применять не только для определения восстановителей и окислителей, но и для
- 27. Недостатки броматометрического метода 1. Вода, присутствующая в растворе или образующаяся в процессе титрования неводных растворов, мешает
- 28. 5. Нитритометрия За основу метода взяты окислительно-восстановительные и диазотирующие свойства NaNО2 (в кислой среде).
- 29. Метод нитритометрии является фармакопейным для определения многих ЛВ, в частности метод диазотирования органических аминов нитритом натрия
- 30. Определяются: восстановители Sn2+, Fe2+, которые восстанавливают NО2 - до NO: HNО2 +1 е + Н+ ↔
- 31. Рабочим раствором является 0,1 М раствор NaNО2 Стандартизуют раствор NaNО2: а) по стандартным веществам (сульфаниловая кислота);
- 32. Индикаторы нитритометрии Конечную точку титрования в нитритометрии фиксируют с помощью внешних и внутренних индикаторов. В качестве
- 34. Скачать презентацию






























 Химия актиноидов
Химия актиноидов Неоадъювантное лечение II-III стадии HER2-положительного рака молочной железы
Неоадъювантное лечение II-III стадии HER2-положительного рака молочной железы Биохимическая трансформация веществ (3)
Биохимическая трансформация веществ (3) Значение Периодического закона Д.И. Менделеева. Жизнь Д.И. Менделеева
Значение Периодического закона Д.И. Менделеева. Жизнь Д.И. Менделеева Презентация по Химии "Алотропія карбону" - скачать смотреть
Презентация по Химии "Алотропія карбону" - скачать смотреть  PSKhE
PSKhE Неорганические вещества клетки
Неорганические вещества клетки Кальций хлорид
Кальций хлорид  Явление изоморфизма в геохимии
Явление изоморфизма в геохимии Уравнение состояния идеального газа. Решение задач
Уравнение состояния идеального газа. Решение задач Установка кристаллов
Установка кристаллов Анализ лекарственных средств паминофенола, ароматических кислот: бензойная кислота, натрия бензоат, салициловая кислота
Анализ лекарственных средств паминофенола, ароматических кислот: бензойная кислота, натрия бензоат, салициловая кислота Фосфор красный, белый и черный
Фосфор красный, белый и черный Органика в ЕГЭ (В,С)
Органика в ЕГЭ (В,С) Презентация Оксиды углерода
Презентация Оксиды углерода Неоднородные системы, их классификация, методы разделения. Лекция 4
Неоднородные системы, их классификация, методы разделения. Лекция 4 Презентация по Химии "Малахіт" - скачать смотреть
Презентация по Химии "Малахіт" - скачать смотреть  Розчини високомолекулярних сполук
Розчини високомолекулярних сполук Комплексные соединения
Комплексные соединения Виды парфюмерно-косметической косметики
Виды парфюмерно-косметической косметики Тест- тренажер по теме: Основные классы неорганических веществ «Оксиды»
Тест- тренажер по теме: Основные классы неорганических веществ «Оксиды» Образовательная программа дополнительного образования Химия в центре наук
Образовательная программа дополнительного образования Химия в центре наук Вода Основні забруднювачі: нафтопродукти; пестициди, синтетичні миючі засоби; кислоти, луги, мінеральні солі; відходи тв
Вода Основні забруднювачі: нафтопродукти; пестициди, синтетичні миючі засоби; кислоти, луги, мінеральні солі; відходи тв Вплив хімічних сполук на довкілля і здоров'я людини
Вплив хімічних сполук на довкілля і здоров'я людини Addition reactions
Addition reactions Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Бензол: строение и свойства
Бензол: строение и свойства Золото ЗОЛОТО Au (читается «аурум»), химический элемент с атомным номером 79, атомная масса 196,9665. Известно с глубокой древности. В при
Золото ЗОЛОТО Au (читается «аурум»), химический элемент с атомным номером 79, атомная масса 196,9665. Известно с глубокой древности. В при