Содержание
- 2. Цель: Повторить основные теоретические вопросы программы 8 класса; Закрепить знания о причинах изменения свойств химических элементов
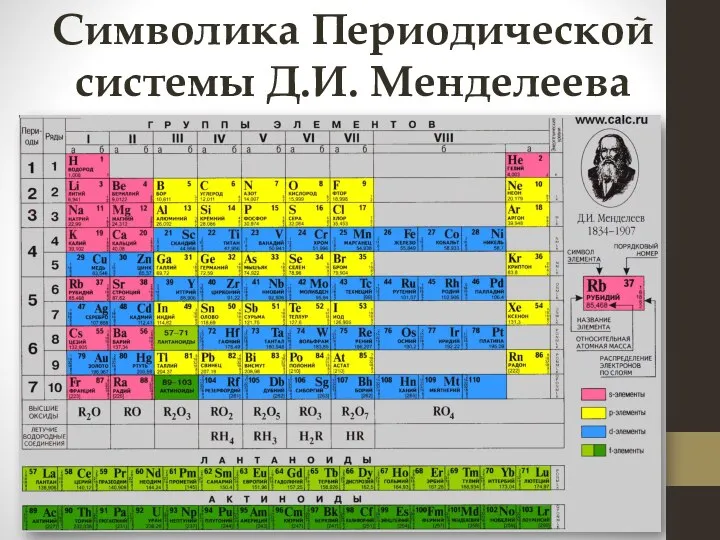
- 3. Символика Периодической системы Д.И. Менделеева
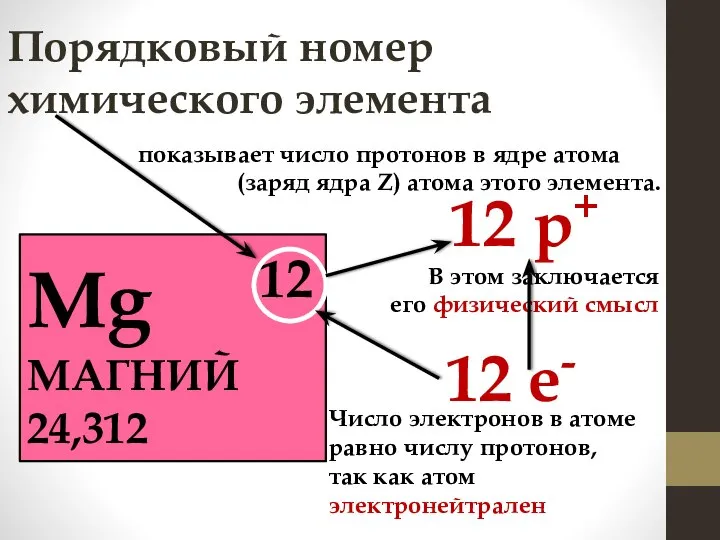
- 4. Порядковый номер химического элемента Mg 12 МАГНИЙ 24,312 12 р+ 12 е- показывает число протонов в
- 5. Закрепим! Са 20 КАЛЬЦИЙ 40,08 Z = +20 20 р+ 20 е- S S 32 СЕРА
- 6. Закрепим! Zn 30 ЦИНК 65,37 Z = +30 30 р+ 30 е- S Br 35 БРОМ
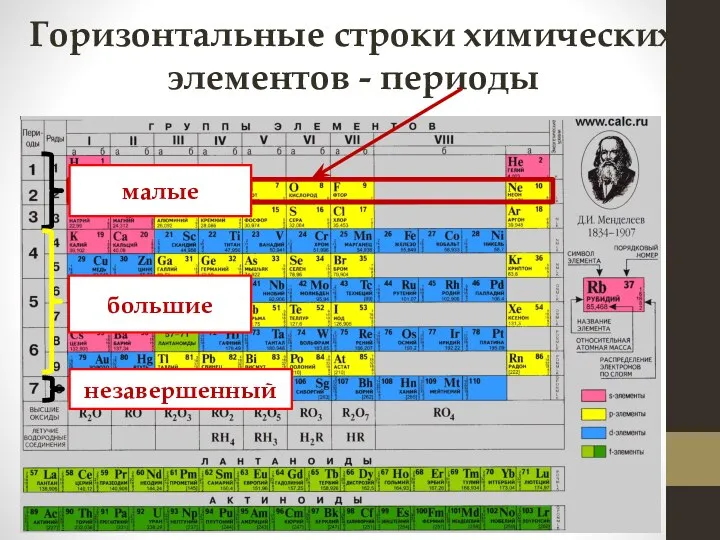
- 7. Горизонтальные строки химических элементов - периоды малые большие незавершенный
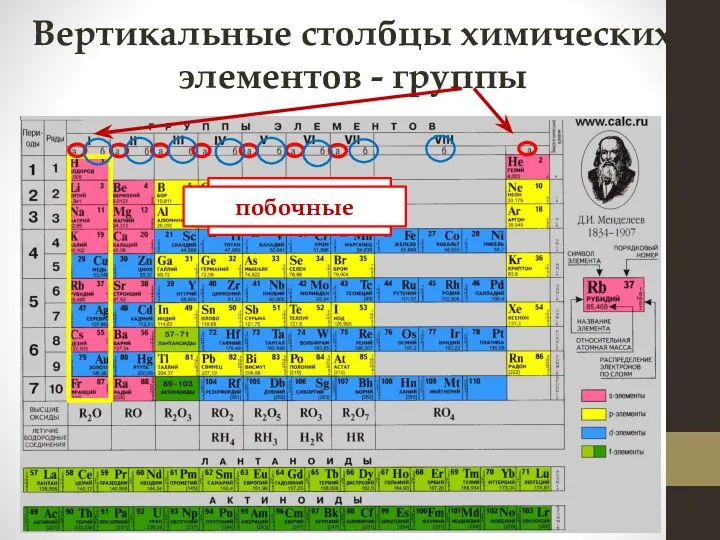
- 8. Вертикальные столбцы химических элементов - группы главные побочные
- 9. Пример записи схемы строения атома химического элемента 11Na 23 +11 Число электронных слоев в электронной оболочке
- 10. Закрепим! 13Al 27 +13 13р+ 13е- - 14 n0 Заряд ядра атома (Z) алюминия 3 2∙12
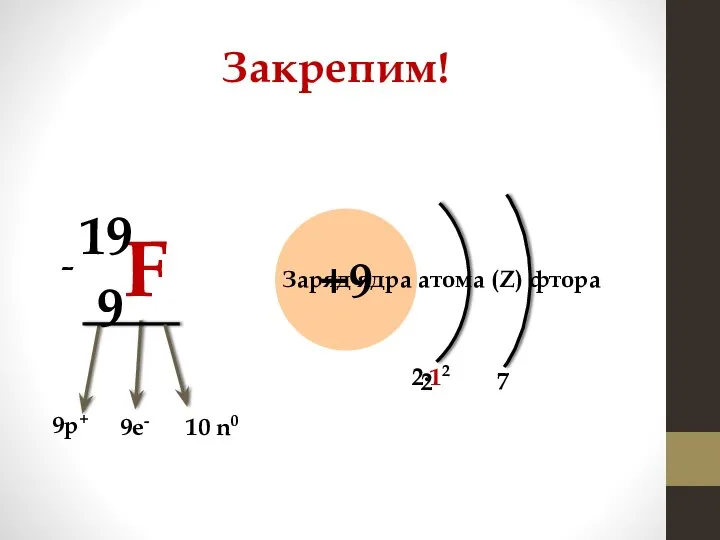
- 11. Закрепим! 9F 19 +9 9р+ 9е- - 10 n0 Заряд ядра атома (Z) фтора 7 2∙12
- 12. ЗАКОНОМЕРНОСТИ ИЗМЕНЕНИЯ СВОЙСТВ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- 13. В пределах одного периода 1. Возрастают: I II III IV V VI VII VIII Li Be
- 14. В пределах одного периода 2. Уменьшаются: I II III IV V VI VII VIII Li Be
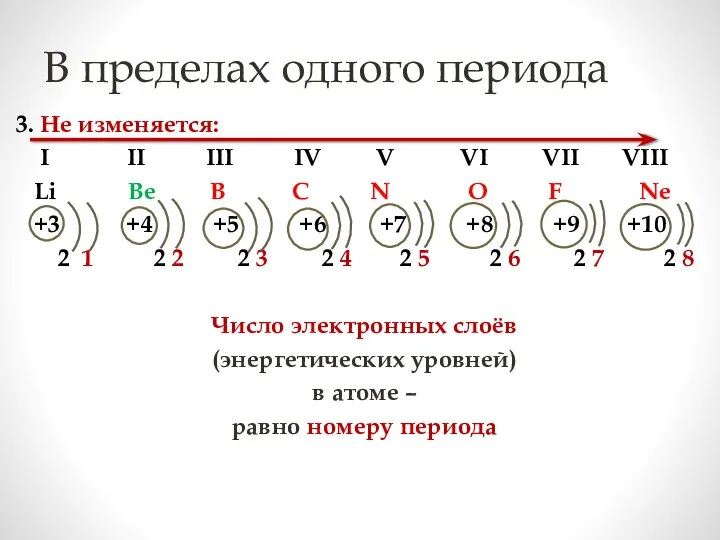
- 15. В пределах одного периода 3. Не изменяется: I II III IV V VI VII VIII Li
- 16. Закрепим! В периодах слева направо заряд ядра атома Увеличивается Уменьшается Не изменяется Сначала увеличивается, а затем
- 17. Закрепим! В периодах справа налево число энергетических уровней Увеличивается Уменьшается Не изменяется Сначала увеличивается, а затем
- 18. Закрепим! В периодах слева направо восстановительные свойства элемента Усиливаются Ослабевают Не изменяются Сначала ослабевают, а затем
- 19. Закрепим! Атомы химических элементов алюминия и кремния имеют одинаковое: Значение зарядов ядер атомов; Число электронов на
- 20. Закрепим! Атомы химических элементов серы и хлора имеют различное: Значение зарядов ядер атомов; Число электронов на
- 21. В пределах одной А группы 1. Возрастают: I А Li +3 Na +11 K +19 Rb
- 22. В пределах одной А группы 2. Уменьшаются: VII А F +9 Cl +17 Br +35 I
- 23. В пределах одной А группы 3. Не изменяются: II А Be +4 Mg +12 Ca +20
- 24. Закрепим! В главных подгруппах снизу вверх заряд ядра атома Увеличивается Уменьшается Не изменяется Сначала увеличивается, а
- 25. Закрепим! В главных подгруппах снизу вверх число электронов на внешнем уровне Увеличивается Уменьшается Не изменяется Сначала
- 26. Закрепим! В главных подгруппах снизу вверх окислительные свойства элемента Усиливаются Ослабевают Не изменяется Сначала увеличивается, а
- 27. Закрепим! Атомы химических элементов углерода и кремния имеют одинаковое: Значение зарядов ядер атомов; Число электронов на
- 28. Закрепим! Атомы химических элементов азота и фосфора имеют различное: Значение зарядов ядер атомов; Число электронов на
- 29. Домашнее задание: § 36, тест стр. 268-272
- 30. Спасибо за активную работу!
- 32. Скачать презентацию























 Основные классы органических соединений и их роль в живых организмах
Основные классы органических соединений и их роль в живых организмах СЕРА Учитель химии МКОУ СОШ №3 с.Чикола РСО-Алания Кадохова А.Г.
СЕРА Учитель химии МКОУ СОШ №3 с.Чикола РСО-Алания Кадохова А.Г. Аллотропные модификации углерода ( 8класс)
Аллотропные модификации углерода ( 8класс) Карбоновые кислоты
Карбоновые кислоты Серосодержащие макрогетероциклы (тиакраун-соединения)
Серосодержащие макрогетероциклы (тиакраун-соединения) Полимеры. Классификация полимеров
Полимеры. Классификация полимеров Геохимия метасоматтческого процесса. (Лекция 7)
Геохимия метасоматтческого процесса. (Лекция 7) Металічний хімічний зв’язок
Металічний хімічний зв’язок 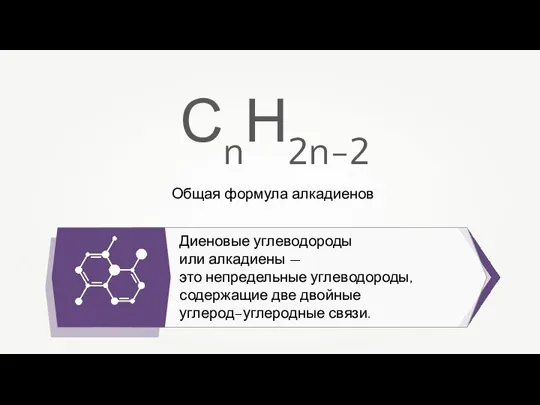 Общая формула алкадиенов
Общая формула алкадиенов Небезпечні речовини
Небезпечні речовини Новые книги по теме Общая и неорганическая химия
Новые книги по теме Общая и неорганическая химия Викторина по теме «Искусственные и синтетические полимеры Выполнила Немцева Т.А. учитель биологии и химии
Викторина по теме «Искусственные и синтетические полимеры Выполнила Немцева Т.А. учитель биологии и химии Аттестационная работа. Развитие творческих возможностей учащихся через организацию исследовательской работы по химии
Аттестационная работа. Развитие творческих возможностей учащихся через организацию исследовательской работы по химии лекарства Урок-защита проектов Разработала учитель химии МОУ «Гимназия №1» г. Саратова Шишкина И.Ю.
лекарства Урок-защита проектов Разработала учитель химии МОУ «Гимназия №1» г. Саратова Шишкина И.Ю.  Стимулсезімтал сополимерлердің полимерлік комплексін зерттеу
Стимулсезімтал сополимерлердің полимерлік комплексін зерттеу Викторина для учащихся 5-7 классов Химия вокруг нас Учитель химии ГБОУ СОШ №814 г.Москва Маркова Н. В.
Викторина для учащихся 5-7 классов Химия вокруг нас Учитель химии ГБОУ СОШ №814 г.Москва Маркова Н. В. Особенности переваривания и всасывания липидов. β – окисление жирных кислот в митохондриях
Особенности переваривания и всасывания липидов. β – окисление жирных кислот в митохондриях Презентация по Химии "Волокнистые материалы вокруг нас" - скачать смотреть
Презентация по Химии "Волокнистые материалы вокруг нас" - скачать смотреть  Сутегінің тотықсыздандырғыш қасиеттері және қолданылуы
Сутегінің тотықсыздандырғыш қасиеттері және қолданылуы Edexcel organic reaction mechanisms
Edexcel organic reaction mechanisms Аттестационная работа. Элективный курс Химия в доме
Аттестационная работа. Элективный курс Химия в доме Қышқылдар мен негіздердің қазіргі заманғы теориясы
Қышқылдар мен негіздердің қазіргі заманғы теориясы Применение центрифугирования
Применение центрифугирования Металлогеническая периодизация истории Земли. Геолого-металлогенические ранги
Металлогеническая периодизация истории Земли. Геолого-металлогенические ранги Галогены
Галогены Растворение. Кристаллогидраты
Растворение. Кристаллогидраты Вредное воздействие нитратов на организм человека Выполнила: ученица 10 класса «А» Средней школы №1120
Вредное воздействие нитратов на организм человека Выполнила: ученица 10 класса «А» Средней школы №1120  Золото Aurum
Золото Aurum