Содержание
- 2. Метод кондуктометрии Основное уравнение: æ= (1/R)·K где æ - удельная электропроводность раствора, R - сопротивление, К
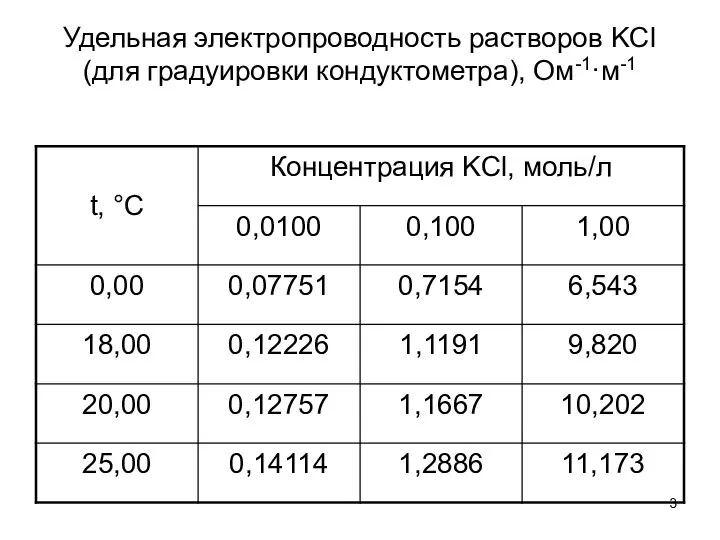
- 3. Удельная электропроводность растворов KCl (для градуировки кондуктометра), Ом-1·м-1
- 4. Примеры применения метода кондуктометрии Определение удельной электропроводности воды и растворителей Определение константы диссоциации слабого электролита Определение
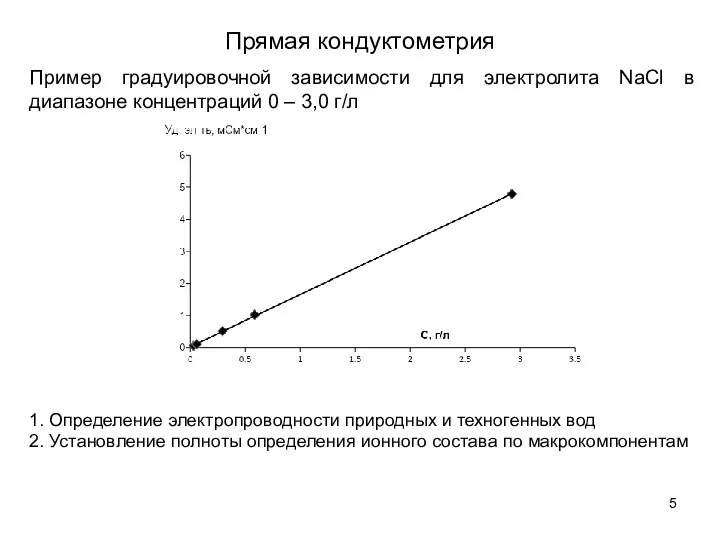
- 5. Прямая кондуктометрия 1. Определение электропроводности природных и техногенных вод 2. Установление полноты определения ионного состава по
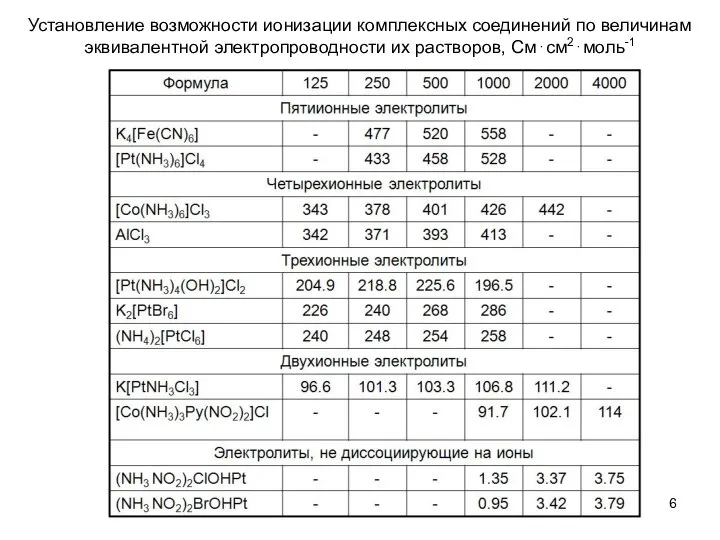
- 6. Установление возможности ионизации комплексных соединений по величинам эквивалентной электропроводности их растворов, См⋅см2⋅моль-1
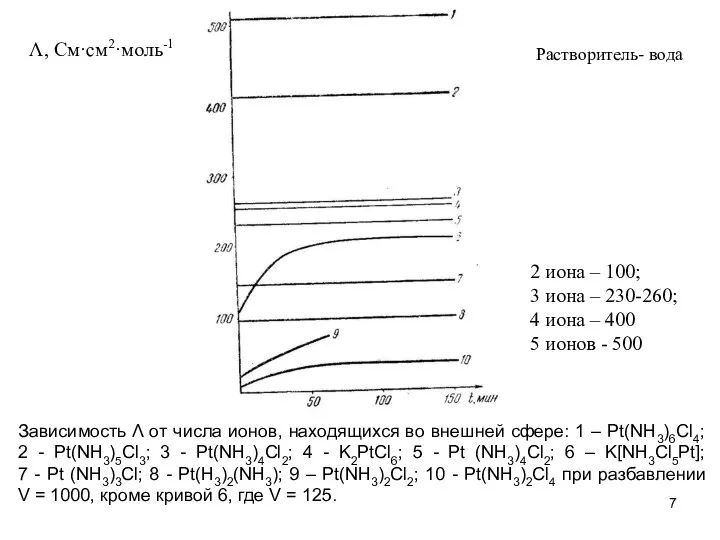
- 7. Λ, См·см2·моль-1 Зависимость Λ от числа ионов, находящихся во внешней сфере: 1 – Pt(NH3)6Cl4; 2 -
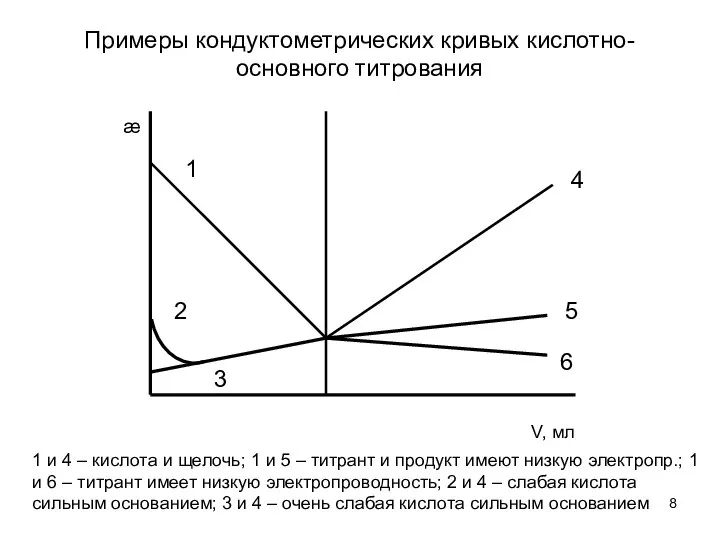
- 8. Примеры кондуктометрических кривых кислотно-основного титрования 1 и 4 – кислота и щелочь; 1 и 5 –
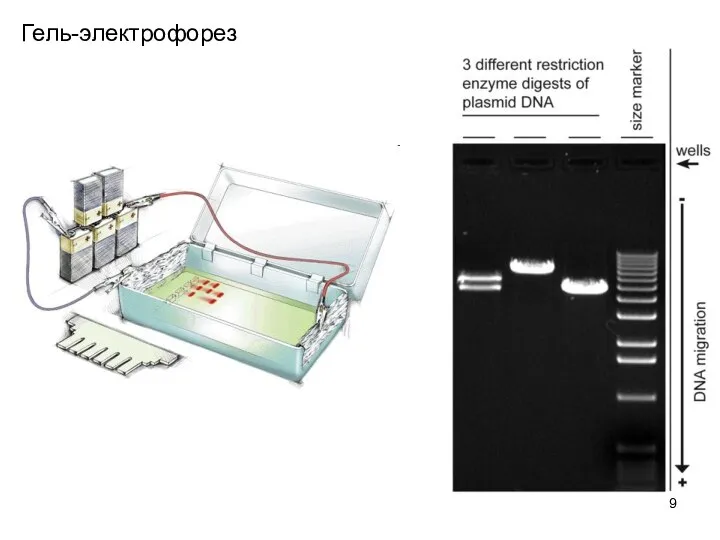
- 9. Гель-электрофорез
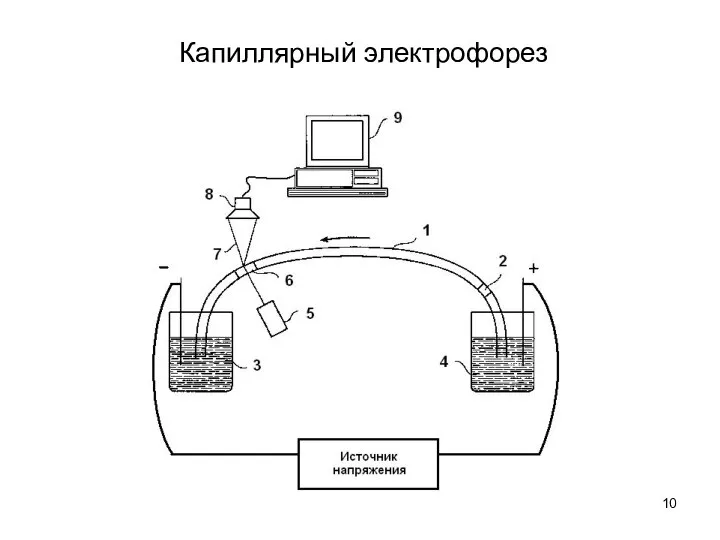
- 10. Капиллярный электрофорез
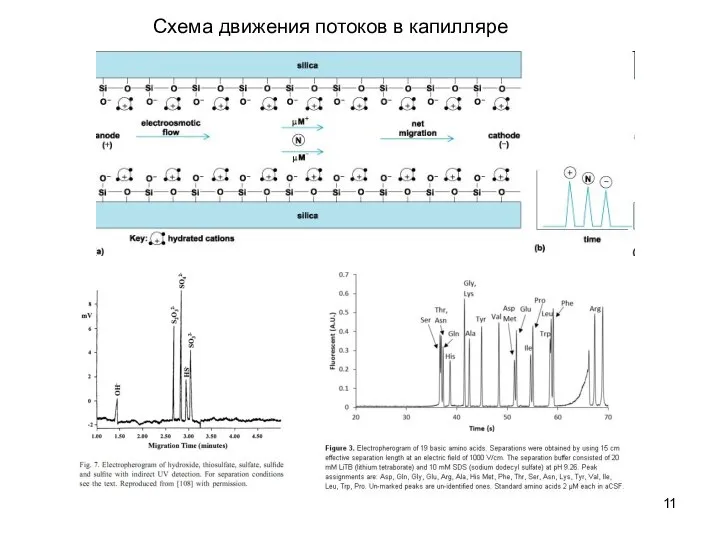
- 11. Схема движения потоков в капилляре
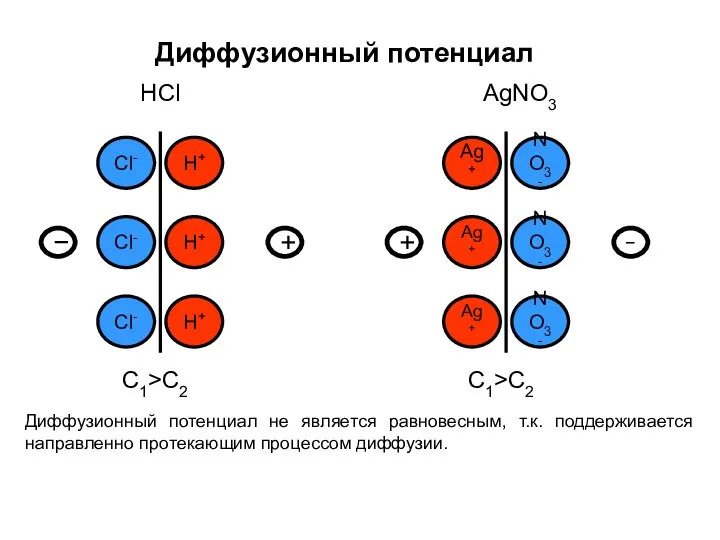
- 12. Диффузионный потенциал не является равновесным, т.к. поддерживается направленно протекающим процессом диффузии. Диффузионный потенциал
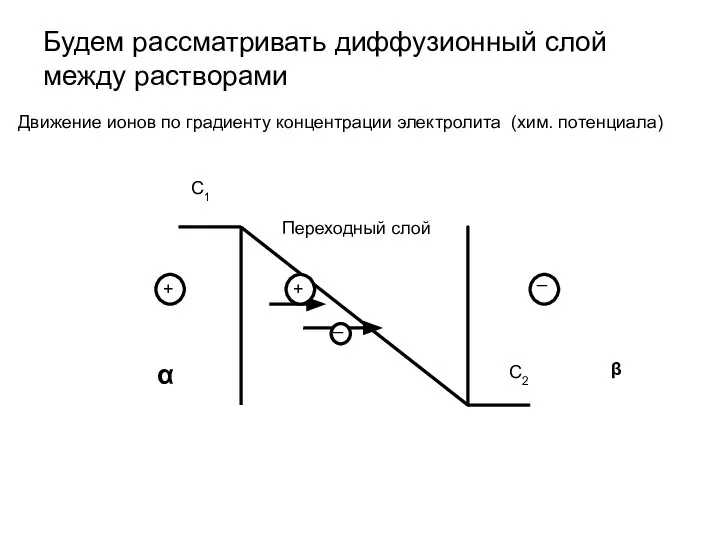
- 13. Будем рассматривать диффузионный слой между растворами Движение ионов по градиенту концентрации электролита (хим. потенциала) Переходный слой
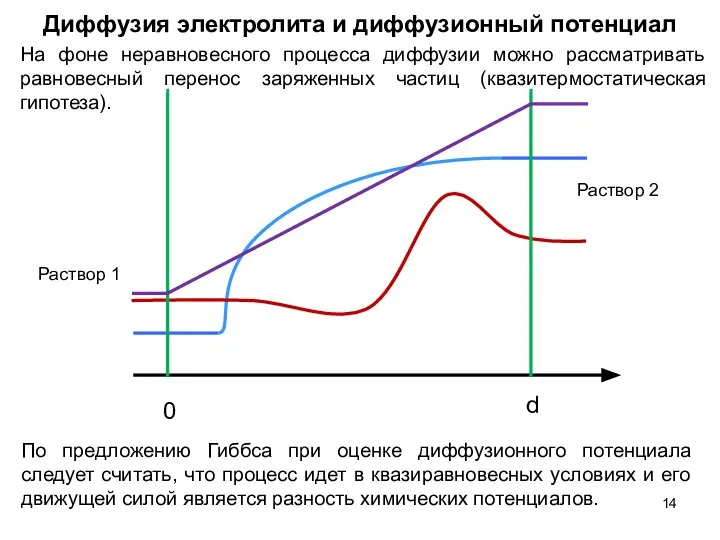
- 14. По предложению Гиббса при оценке диффузионного потенциала следует считать, что процесс идет в квазиравновесных условиях и
- 15. Вывод уравнения для диффузионного потенциала
- 16. Рассмотрим решения уравнения Униполярная проводимость электролита Электролит 1:1 Уравнение Гендерсона и его частные случаи 4. Элиминирование
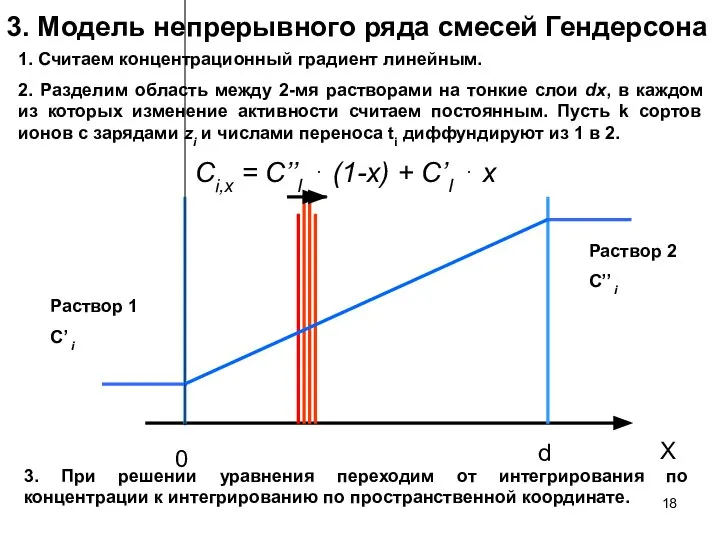
- 18. 3. Модель непрерывного ряда смесей Гендерсона 1. Считаем концентрационный градиент линейным. 2. Разделим область между 2-мя
- 19. Δϕдиф
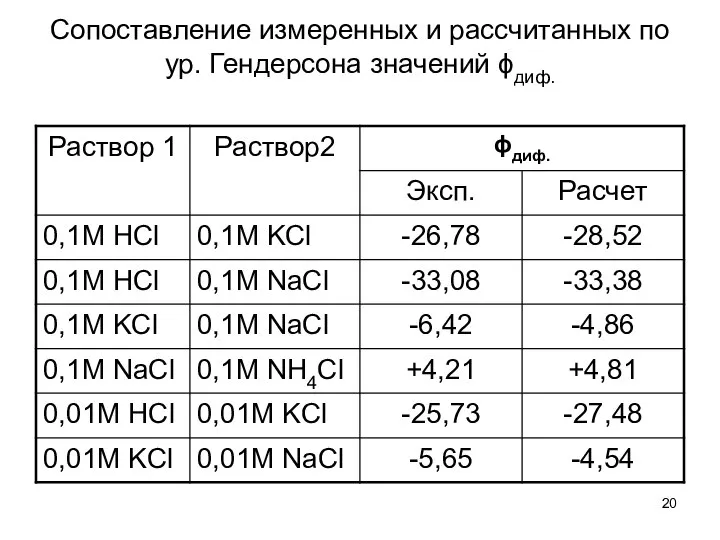
- 20. Сопоставление измеренных и рассчитанных по ур. Гендерсона значений ϕдиф.
- 21. Частные случаи ур. Гендерсона 1. Контактируют 2 раствора одного электролита с разными концентрациями Λ - молярная
- 22. Элиминирование диффузионного потенциала
- 23. 1. Диффузионные потенциалы на жидкостной границе контакта растворов электролитов: - модель непрерывно изменяющейся смеси растворов (модель
- 24. История развития мембранных электродов связана с исследованиями физиологических процессов. В середине ХIХ века физиологи обнаружили возникновение
- 25. Диафрагма – это перегородка между двумя растворами, которая препятствует свободному перемешиванию растворов, ионы (частицы) могут проникать
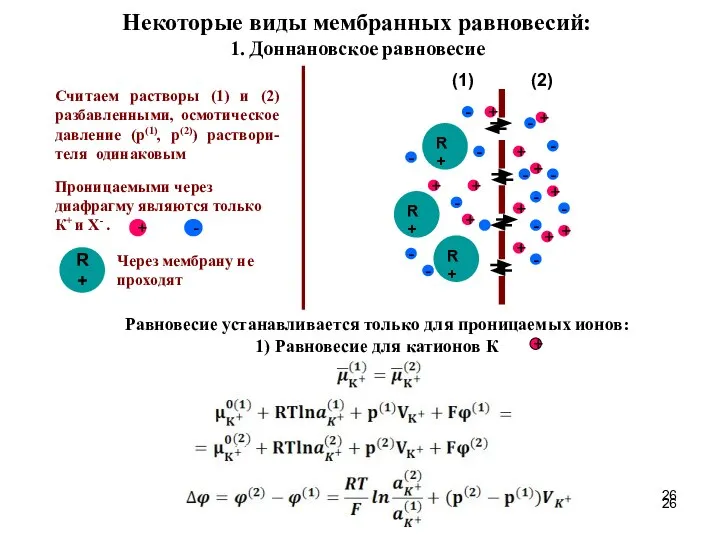
- 26. Некоторые виды мембранных равновесий: 1. Доннановское равновесие
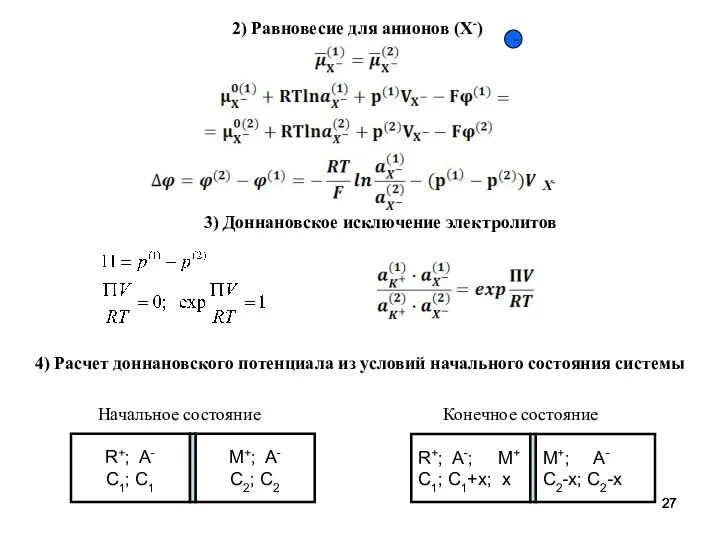
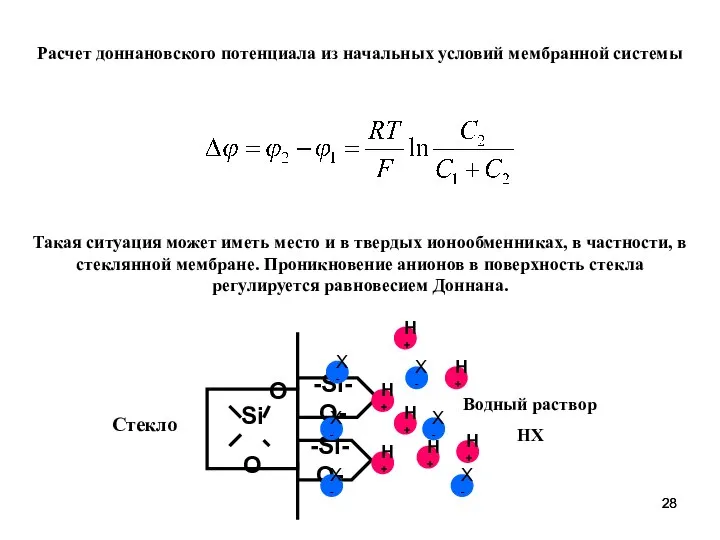
- 27. 2) Равновесие для анионов (X-) - 4) Расчет доннановского потенциала из условий начального состояния системы 3)
- 28. Такая ситуация может иметь место и в твердых ионообменниках, в частности, в стеклянной мембране. Проникновение анионов
- 29. 2.2. Некоторые виды мембранных равновесий 2.2.1. Равновесие и потенциал на границе двух несмешивающихся растворов
- 30. Разделение свободных энергий переноса электролитов на составляющие проводится на основе различного рода нетермодинамических допущений, например: Оценка
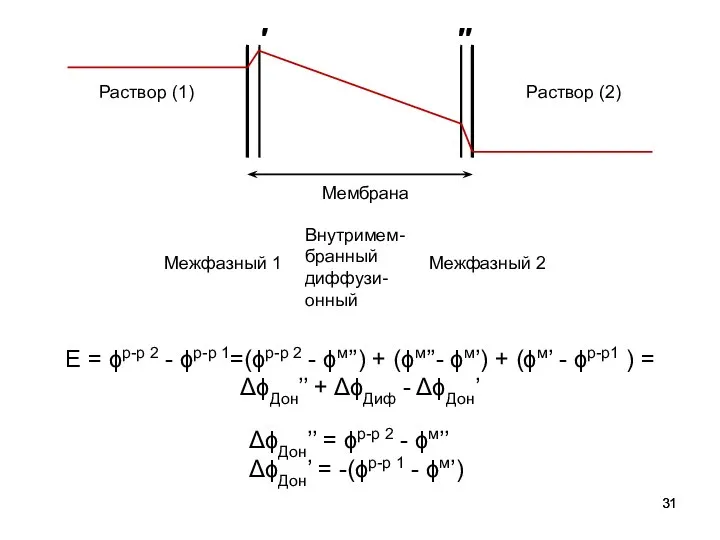
- 31. Мембрана Раствор (1) Раствор (2) E = ϕр-р 2 - ϕр-р 1=(ϕр-р 2 - ϕм’’) +
- 32. Для (например) отрицательно заряженной мембраны ЗДМ будет иметь вид: Теория Теорелла – Мейера - Сиверса для
- 33. Решением уравнения будет: В предположении, что внутримембранный диффузионный потенциал отождествляется с потенциалом жидкостного соединения с затрудненной
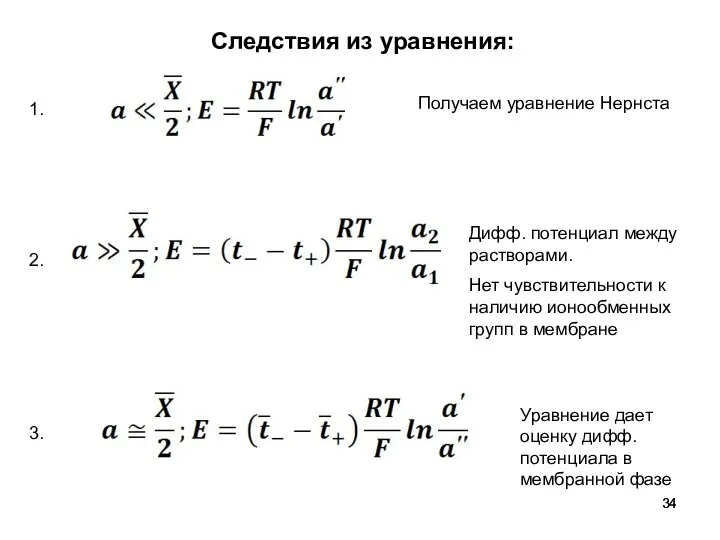
- 34. Следствия из уравнения: 1. 2. 3. Получаем уравнение Нернста Дифф. потенциал между растворами. Нет чувствительности к
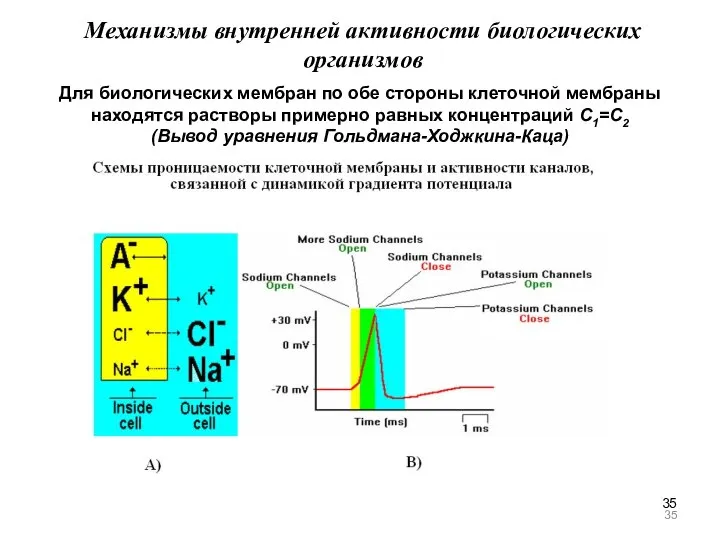
- 35. Механизмы внутренней активности биологических организмов Для биологических мембран по обе стороны клеточной мембраны находятся растворы примерно
- 36. Допущения, принятые при выводе уравнения: Мембрана является гомогенной Электрическое поле в мембране постоянно, поэтому трансмембранный потенциал
- 37. Вывод уравнения Гольдмана-Ходжкина-Каца y Интегрирование от x=0 (in) до x=L (out) приводит к результату: (1) (2)
- 38. Безразмерный параметр Проницаемость Переходим от потока к току (qA – заряд иона): В предположении, что общий
- 39. Если мембрана разделяет 2 раствора равных концентраций : Расчет величины потенциала в простейшем случае: Для 37
- 40. Для 37 °С
- 41. Основные типы ИСЭ Ионоселективные электроды – это датчики на основе ионоселективных мембран, позволяющие определять активность (концентрацию)
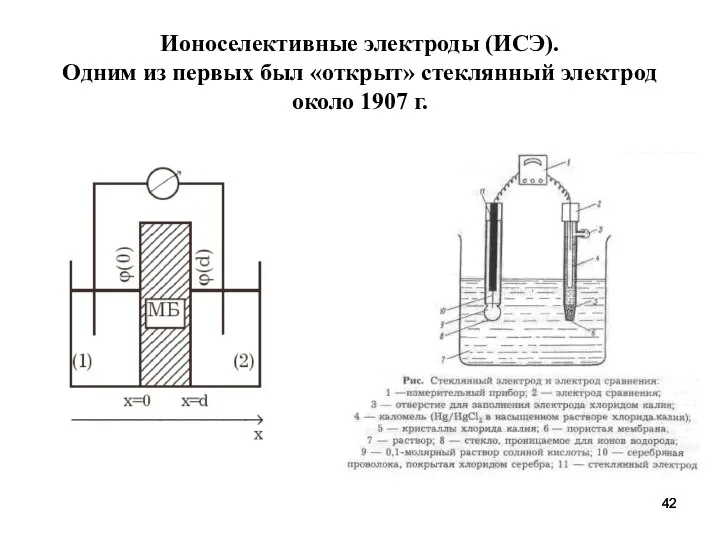
- 42. Ионоселективные электроды (ИСЭ). Одним из первых был «открыт» стеклянный электрод около 1907 г.
- 43. Современный вариант измерительной установки для определения рН Комбинированный электрод 1- стеклянная мембрана 2- токоотводящий электрод 3-
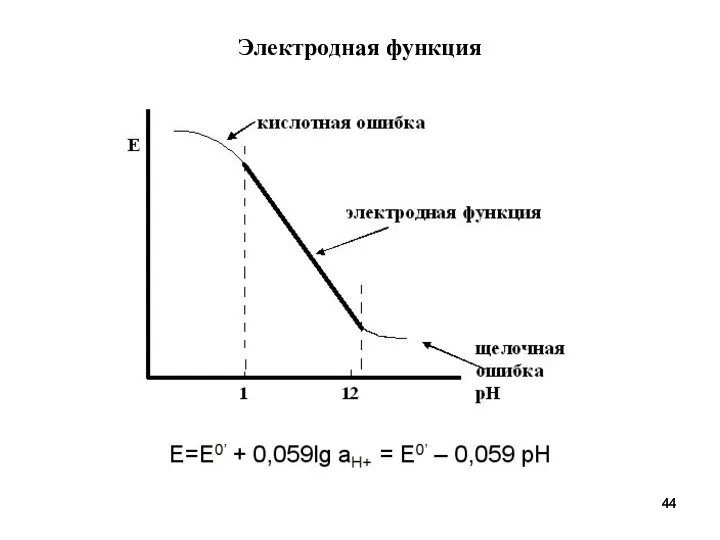
- 44. Электродная функция
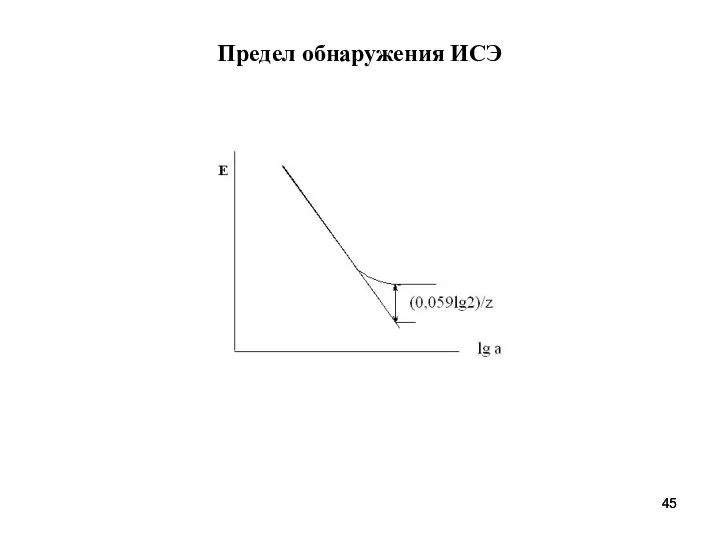
- 45. Предел обнаружения ИСЭ
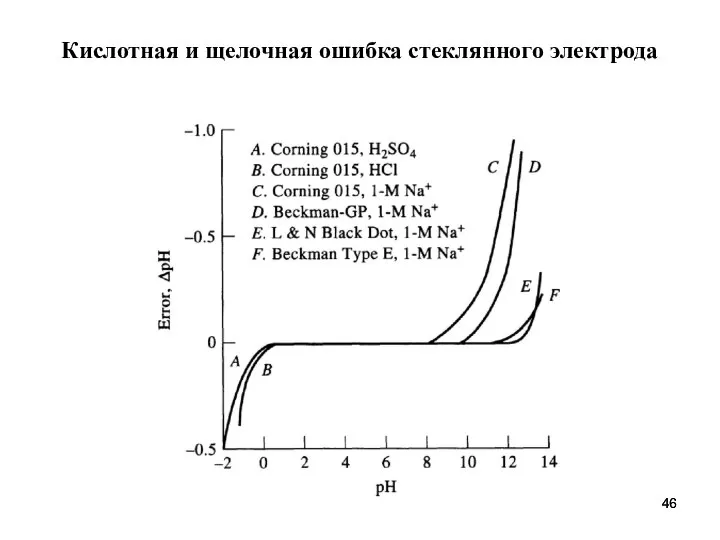
- 46. Кислотная и щелочная ошибка стеклянного электрода
- 47. Принятая запись ячейки
- 48. Основная задача теории ИСЭ Выразить в явной форме зависимость ЭДС ГЦ от состава внешнего (или анализируемого)
- 49. Простая ионообменная теория стеклянного электрода
- 50. Простая ионообменная теория стеклянного электрода
- 51. В простой теории принимаются следующие положения:
- 53. Скачать презентацию





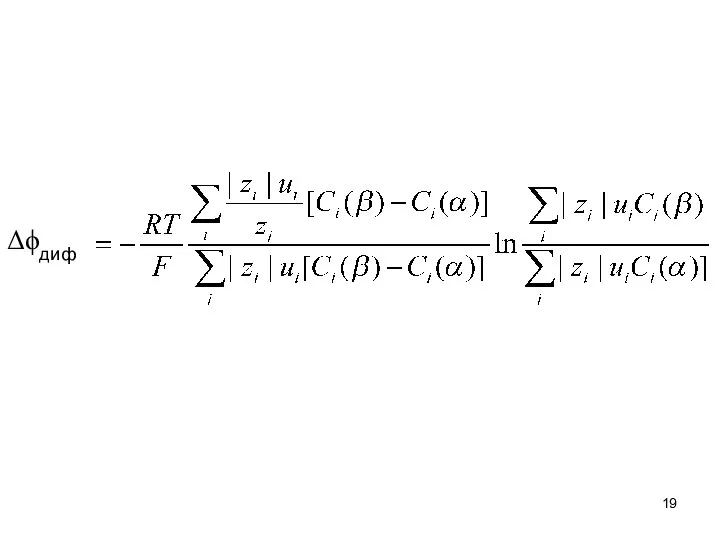





















 Виды химической связи. Кристаллические решетки
Виды химической связи. Кристаллические решетки История изучения углеродных нанотрубок и композиционных материалов на основе полиуретанового связующего
История изучения углеродных нанотрубок и композиционных материалов на основе полиуретанового связующего Горючие полезные ископаемые, топливно-энергетические ресурсы
Горючие полезные ископаемые, топливно-энергетические ресурсы Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Великие химики
Великие химики  Элементы V группы главной подгруппы
Элементы V группы главной подгруппы Сероводород и оксид серы
Сероводород и оксид серы Пятичленные гетероциклические соединения. Профильный уровень
Пятичленные гетероциклические соединения. Профильный уровень Ферум. Залізо ПІДГОТУВАВ УЧЕНЬ 8-Б КЛАСУ
Ферум. Залізо ПІДГОТУВАВ УЧЕНЬ 8-Б КЛАСУ  Некоторые аспекты физической и коллоидной химии
Некоторые аспекты физической и коллоидной химии Металлы и сплавы -материал для древних и современных олимпийских наград.
Металлы и сплавы -материал для древних и современных олимпийских наград. Презентация по Химии "ГАЛЕРЕЯ РУССКИХ ХИМИКОВ" - скачать смотреть бесплатно
Презентация по Химии "ГАЛЕРЕЯ РУССКИХ ХИМИКОВ" - скачать смотреть бесплатно Алкены. Олефины, этиленовые углеводороды. (Лекция 5)
Алкены. Олефины, этиленовые углеводороды. (Лекция 5) Биосинтез и катаболизм пуриновых и пиримидиновых нуклеотидов
Биосинтез и катаболизм пуриновых и пиримидиновых нуклеотидов Химические свойства насыщенных одноатомных спиртов
Химические свойства насыщенных одноатомных спиртов Олигомеризация олефинов
Олигомеризация олефинов Основные типы химических реакций
Основные типы химических реакций Электролиз. 9 класс
Электролиз. 9 класс Глюкоза – это спирт, альдегид или альдегидоспирт?
Глюкоза – это спирт, альдегид или альдегидоспирт? Aromatik uglevodorodlar (Arenlar)
Aromatik uglevodorodlar (Arenlar) Соединения галогенов.
Соединения галогенов. Аллотропия. Аллотропные модификации
Аллотропия. Аллотропные модификации Классификация аминокислот в зависимости от природы радикалов
Классификация аминокислот в зависимости от природы радикалов Готовимся к ЕГЭ Окислительно-восстановительные реакции
Готовимся к ЕГЭ Окислительно-восстановительные реакции Свойства моторных топлив
Свойства моторных топлив Physical chemistry of nanostructured systems.( lecture no. 7)
Physical chemistry of nanostructured systems.( lecture no. 7) Щавелевая кислота
Щавелевая кислота Составления электронных и электронно-графических схем строения атома Разработал: учитель химии высшей категории Лебедев Сергей
Составления электронных и электронно-графических схем строения атома Разработал: учитель химии высшей категории Лебедев Сергей