Содержание
- 2. Многоядерные Арены Приматические углеводороды, содержащие два и более бензольных ядер, относятся к многоядерным аренам. В зависимости
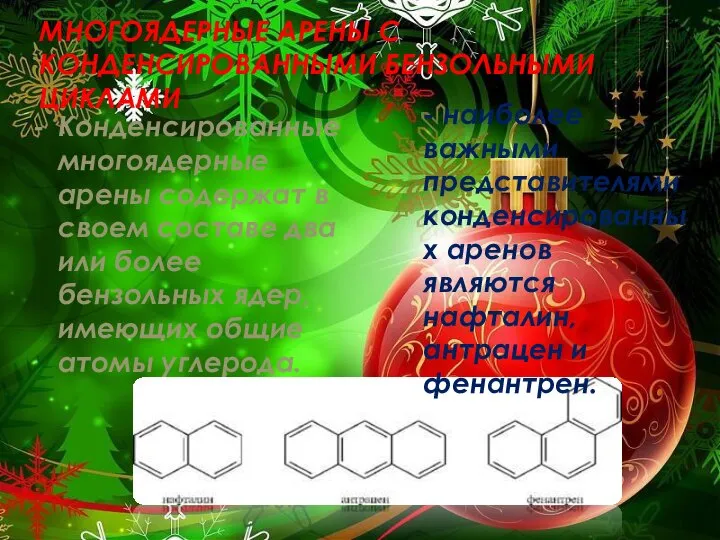
- 3. МНОГОЯДЕРНЫЕ АРЕНЫ С КОНДЕНСИРОВАННЫМИ БЕНЗОЛЬНЫМИ ЦИКЛАМИ Конденсированные многоядерные арены содержат в своем составе два или более
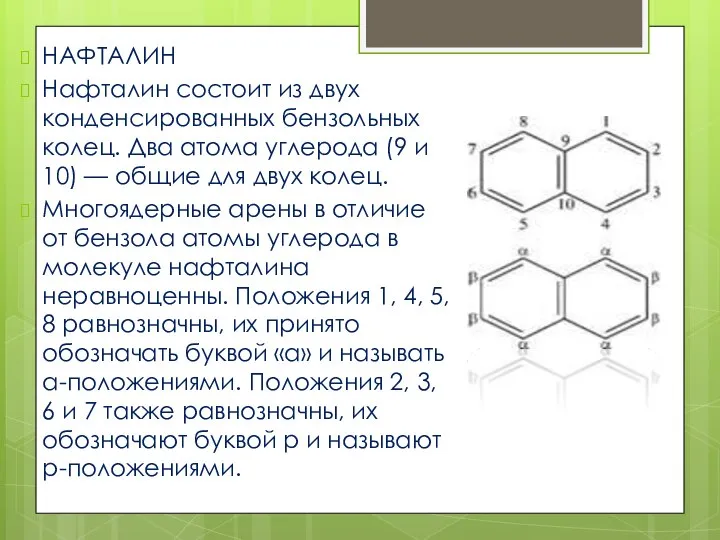
- 4. НАФТАЛИН Нафталин состоит из двух конденсированных бензольных колец. Два атома углерода (9 и 10) — общие
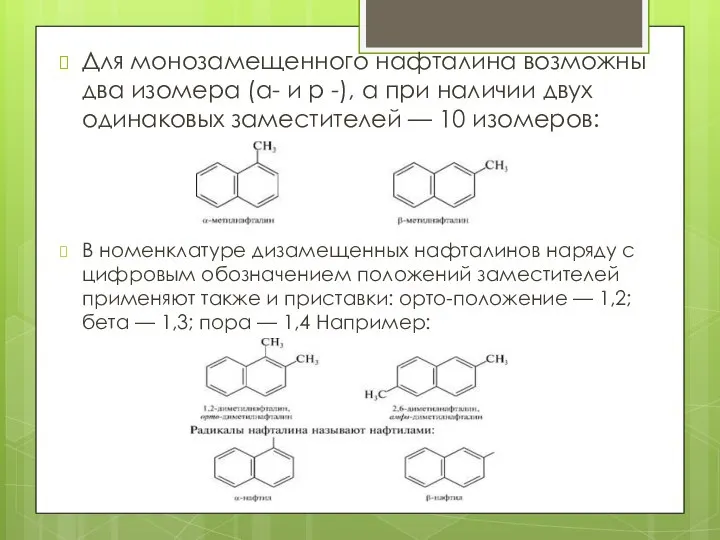
- 5. Для монозамещенного нафталина возможны два изомера (а- и р -), а при наличии двух одинаковых заместителей
- 6. Получение Нафталина. 1. В промышленности нафталин главным образом получают из каменноугольной смолы, где его содержание составляет
- 7. нафталин — кристаллическое вещество с характерным запахом, сублимируется при 81 °С. Не растворяется в воде, растворяется
- 8. Химические свойства Нафталина. Нафталин, как и бензол, проявляет свойства ароматических соединений; для него характерны прежде всего
- 9. Как видно, при атаке а-положения делокализация положительного заряда в с -комплексе происходит с сохранением ароматичности одного
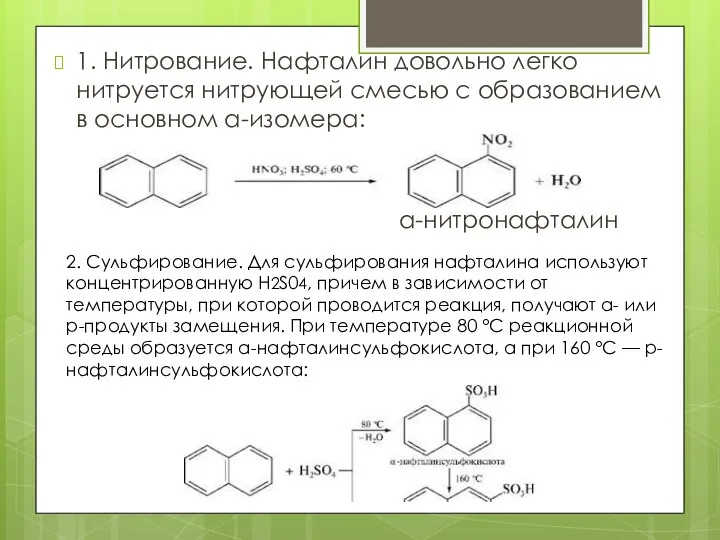
- 10. 1. Нитрование. Нафталин довольно легко нитруется нитрующей смесью с образованием в основном а-изомера: а-нитронафталин 2. Сульфирование.
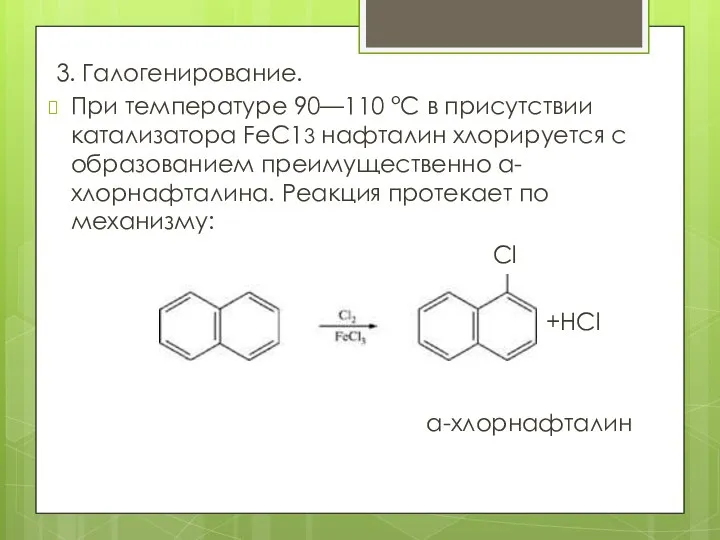
- 11. 3. Галогенирование. При температуре 90—110 °С в присутствии катализатора FеС13 нафталин хлорируется с образованием преимущественно а-хлорнафталина.
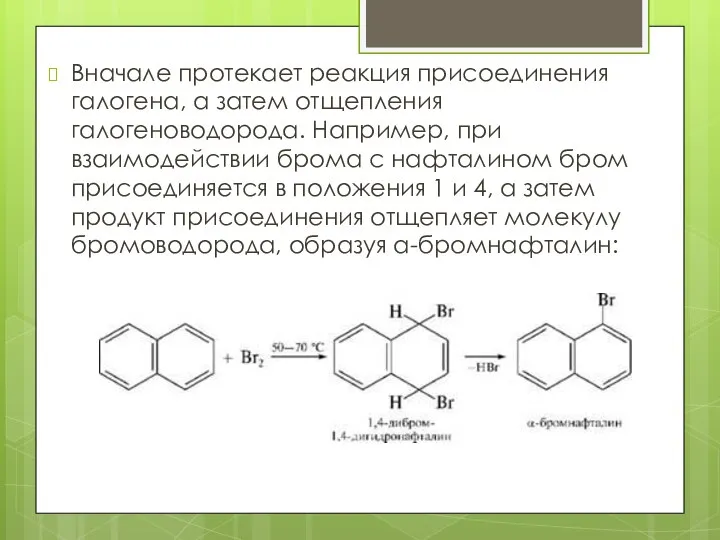
- 12. Вначале протекает реакция присоединения галогена, а затем отщепления галогеноводорода. Например, при взаимодействии брома с нафталином бром
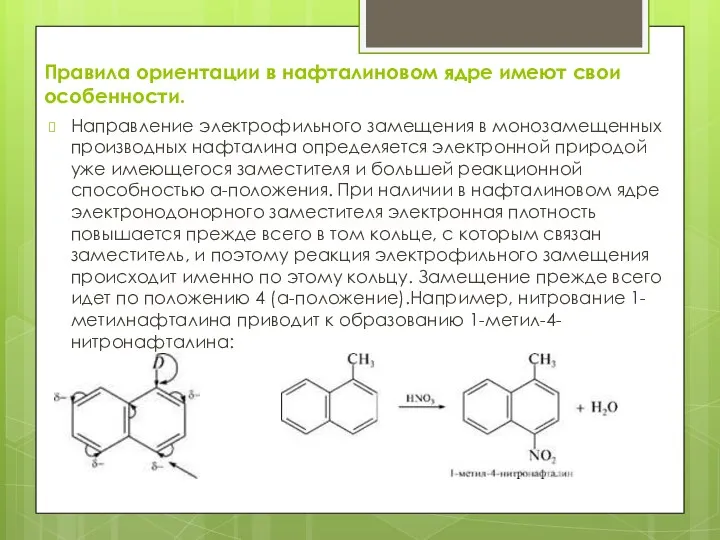
- 13. Правила ориентации в нафталиновом ядре имеют свои особенности. Направление электрофильного замещения в монозамещенных производных нафталина определяется
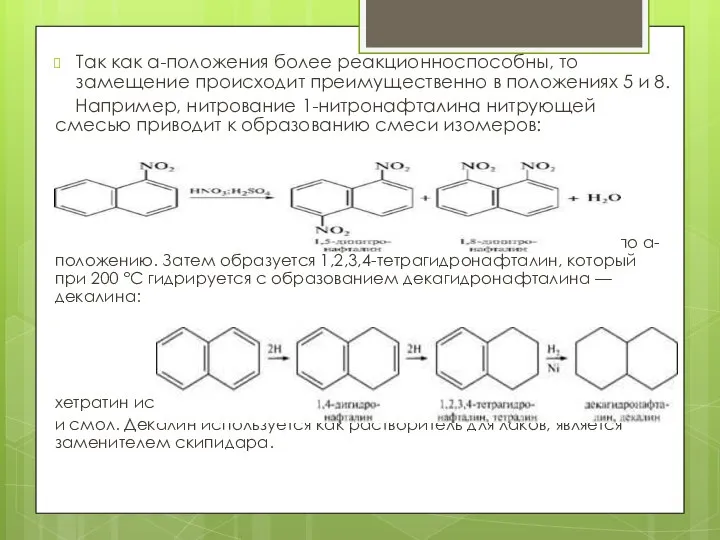
- 14. Так как а-положения более реакционноспособны, то замещение происходит преимущественно в положениях 5 и 8. Например, нитрование
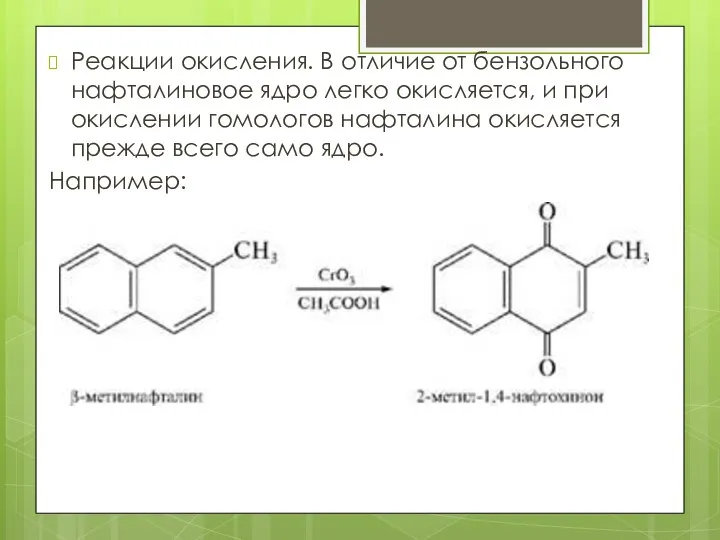
- 15. Реакции окисления. В отличие от бензольного нафталиновое ядро легко окисляется, и при окислении гомологов нафталина окисляется
- 16. Антрацен это многоядерное соединение, состоящее из трех линейно конденсированных бензольных колец. В молекуле антрацена нумеруются лишь
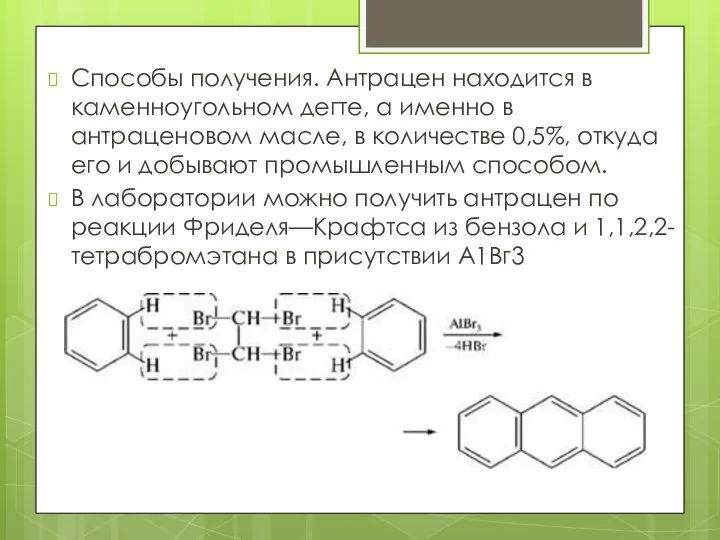
- 17. Способы получения. Антрацен находится в каменноугольном дегте, а именно в антраценовом масле, в количестве 0,5%, откуда
- 18. Физические свойства. Антрацен — это бесцветное кристаллическое вещество, температура плавления 217 °С, перегоняющееся с водяным паром,
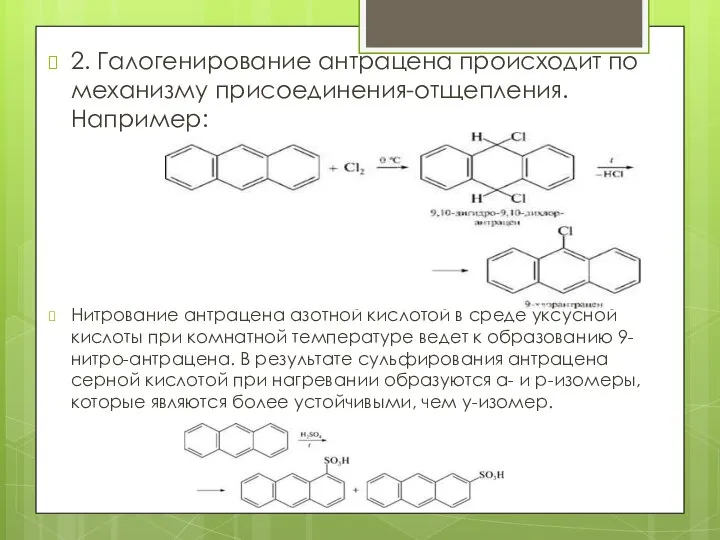
- 19. 2. Галогенирование антрацена происходит по механизму присоединения-отщепления. Например: Нитрование антрацена азотной кислотой в среде уксусной кислоты
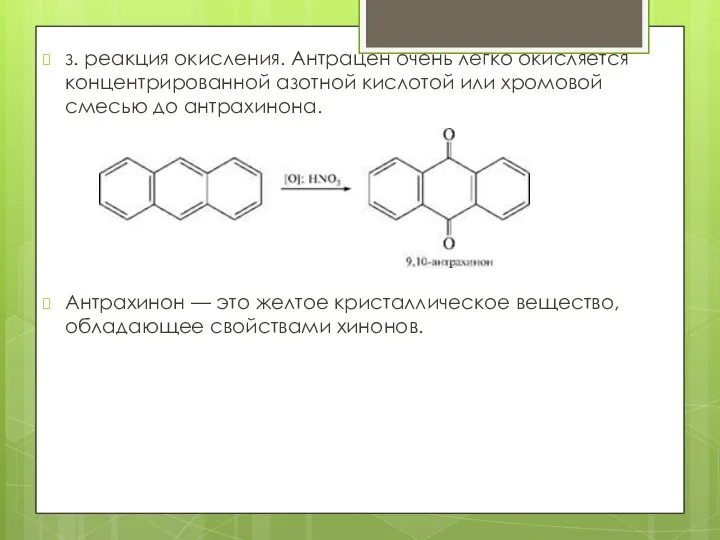
- 20. з. реакция окисления. Антрацен очень легко окисляется концентрированной азотной кислотой или хромовой смесью до антрахинона. Антрахинон
- 21. ФЕНАНТРЕН Структурным изомером антрацена является фенантрен. В антрацене три бензольных кольца соединены линейно, тогда как в
- 22. Физические свойства фенантрена. Фенантрен — это твердое кристаллическое вещество tкип = 340,2 °С. Растворяется в эфире,
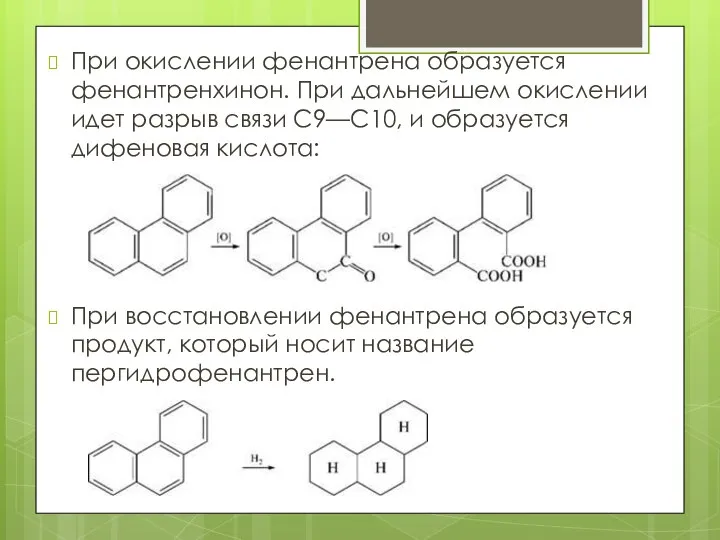
- 23. При окислении фенантрена образуется фенантренхинон. При дальнейшем окислении идет разрыв связи С9—С10, и образуется дифеновая кислота:
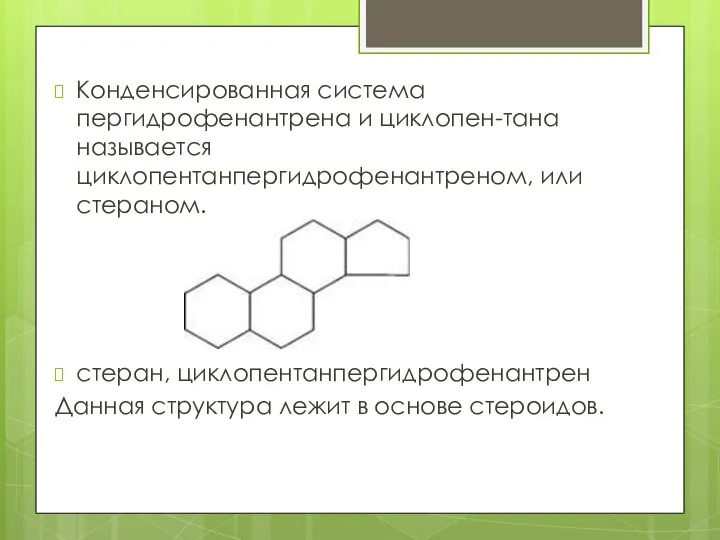
- 24. Конденсированная система пергидрофенантрена и циклопен-тана называется циклопентанпергидрофенантреном, или стераном. стеран, циклопентанпергидрофенантрен Данная структура лежит в основе
- 26. Скачать презентацию









 Методика расчета горения топлива
Методика расчета горения топлива МОЛЬ. МОЛЯРНАЯ МАССА.
МОЛЬ. МОЛЯРНАЯ МАССА. Сейсморазведка
Сейсморазведка Фосфонсірке қышқылының антипирендік қасиеттерін зерттеу
Фосфонсірке қышқылының антипирендік қасиеттерін зерттеу Электролиз. Постоянный ток
Электролиз. Постоянный ток The Krebs cycle
The Krebs cycle Метангидратное ружье. Задача 3. Команда: Когнитивная машина
Метангидратное ружье. Задача 3. Команда: Когнитивная машина Полиэтилен
Полиэтилен Задача №5. Свинцовый водопровод. Команда «Карбораны»
Задача №5. Свинцовый водопровод. Команда «Карбораны» Основы химической коррозии
Основы химической коррозии Материалы для газовой сварки
Материалы для газовой сварки Светоносный элемент
Светоносный элемент Ароматические углеводороды
Ароматические углеводороды Строение молекул некоторых широко распространенных гербицидов
Строение молекул некоторых широко распространенных гербицидов Металлы s-семейства
Металлы s-семейства Вода - Н2О
Вода - Н2О Методы выращивания кристаллов. Метод Киропулуса
Методы выращивания кристаллов. Метод Киропулуса Жиры и масла Выполнила ученица 10 «А» класса Кобылкина Яна
Жиры и масла Выполнила ученица 10 «А» класса Кобылкина Яна  ПСХЭ — копия — копия
ПСХЭ — копия — копия Связующие для полимерных композиционных материалов. (Тема 2)
Связующие для полимерных композиционных материалов. (Тема 2) Металлы. 9 класс
Металлы. 9 класс Сахар – практически чистая сахароза
Сахар – практически чистая сахароза Презентация по Химии "Химические элементы в организме чеовека" - скачать смотреть
Презентация по Химии "Химические элементы в организме чеовека" - скачать смотреть  Различные способы решения задач на смеси, сплавы, растворы
Различные способы решения задач на смеси, сплавы, растворы Теоретическое и прикладное материаловедение. (Лекция 7)
Теоретическое и прикладное материаловедение. (Лекция 7) Бромды метил буының концентрациясын анықтау тәсілдемесі
Бромды метил буының концентрациясын анықтау тәсілдемесі Свойства алкадиенов и их получение
Свойства алкадиенов и их получение Химические формулы. Классы неорганических веществ. Урок №1
Химические формулы. Классы неорганических веществ. Урок №1