Содержание
- 2. Изучив тему следует Знать: Физические и химические свойства алкадиенов Способы получения алкадиенов Уметь: Объяснять взаимосвязь строения
- 3. Ответьте на вопросы: Что такое алкадиены? Какие виды алкадиенов различают в зависимости от взаимного расположения двойных
- 6. Какие виды изомерии характерны для алкадиенов? 1. CH2 = CH – CH = CH2 2. CH2
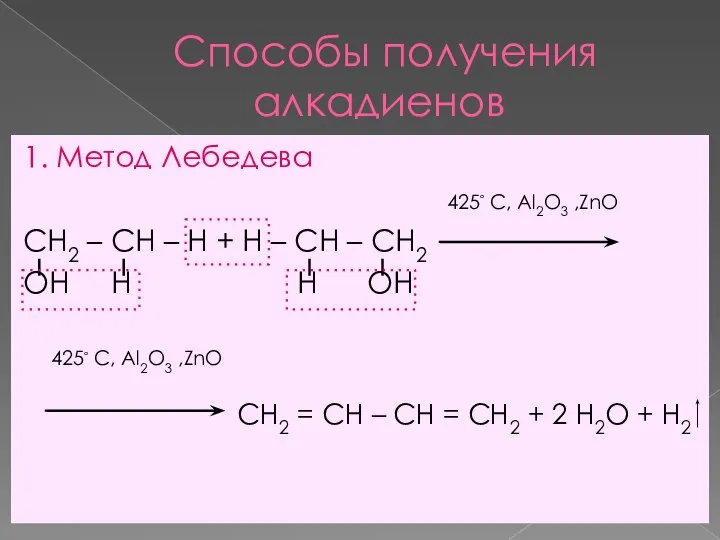
- 7. Способы получения алкадиенов 1. Метод Лебедева 425◦ С, Al2O3 ,ZnO СН2 – СН – Н +
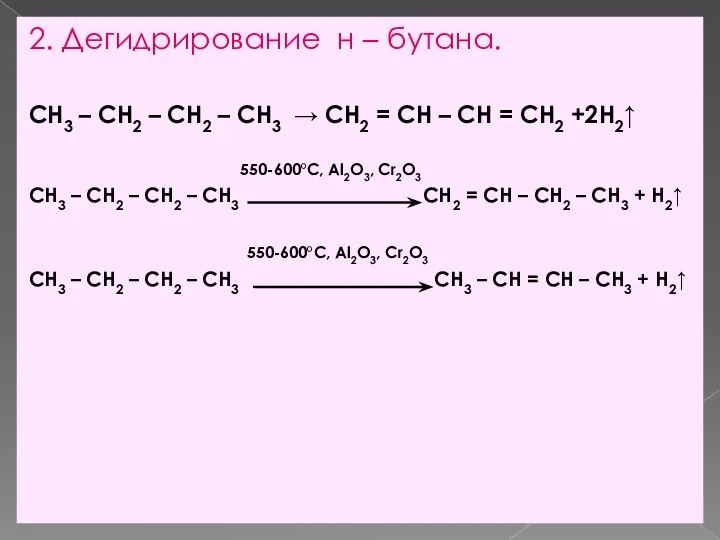
- 8. 2. Дегидрирование н – бутана. CH3 – CH2 – CH2 – CH3 → CH2 = CH
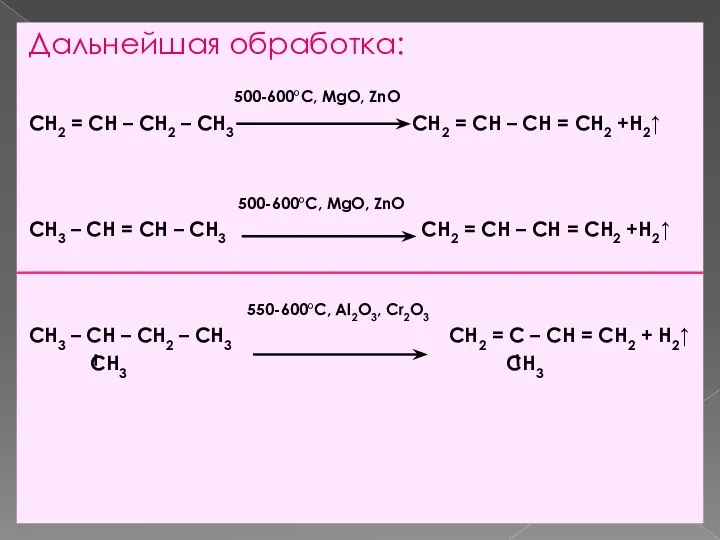
- 9. Дальнейшая обработка: 500-600°С, MgO, ZnO CH2 = CH – CH2 – CH3 CH2 = CH –
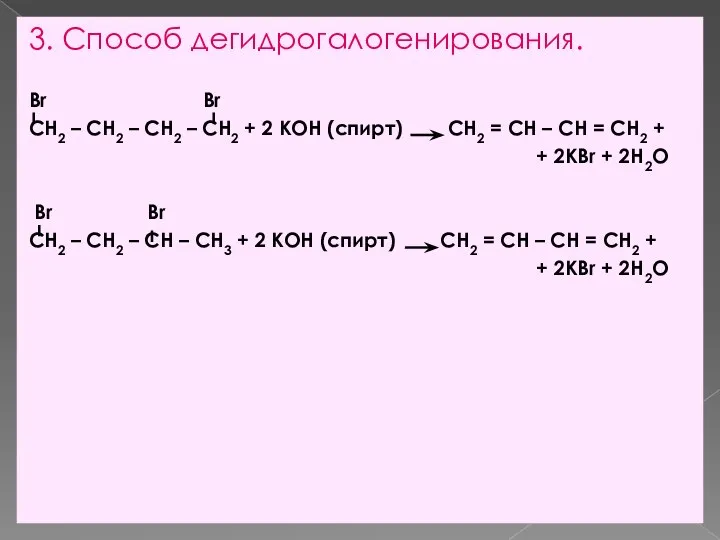
- 10. 3. Способ дегидрогалогенирования. Br Br CH2 – CH2 – CH2 – CH2 + 2 КОН (спирт)
- 11. Химические свойства алкадиенов 1. Реакции присоединения а) гидрирования CH2 = CH – CH = CH2 +
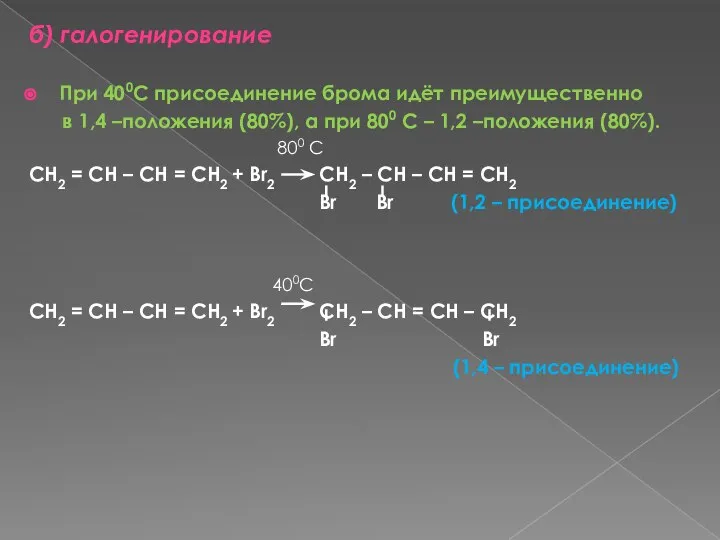
- 12. б) галогенирование При 400С присоединение брома идёт преимущественно в 1,4 –положения (80%), а при 800 С
- 13. в) гидрогалогенирование Запишите уравнение реакции гидрогалогенирования на примере бутадиена – 1,3. Объясните 1,2 - присоединение галогенаводорода
- 14. Механизм электрофильного присоединения галогеноводорода к алкадиену. 1,2 - присоединение CH2 = CH – CH = CH2
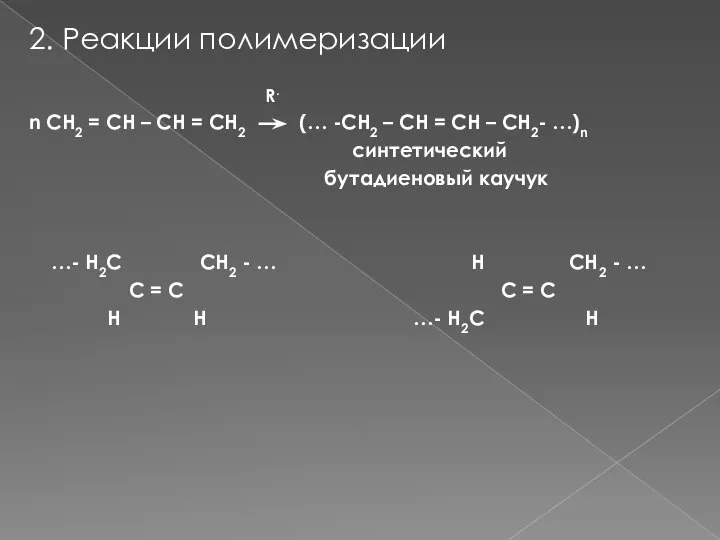
- 15. 2. Реакции полимеризации R. n CH2 = CH – CH = CH2 (… -CH2 – CH
- 18. Скачать презентацию









 Тема: Липиды. Лекция № 2 для студентов 2 курса
Тема: Липиды. Лекция № 2 для студентов 2 курса Презентація на тему: Корозія. Шляхи захисту від неї.
Презентація на тему: Корозія. Шляхи захисту від неї.  Строение атома
Строение атома Презентация по Химии "Жири,вуглеводи,білки,втаміни як компоненти їжі" - скачать смотреть бесплатно
Презентация по Химии "Жири,вуглеводи,білки,втаміни як компоненти їжі" - скачать смотреть бесплатно Хімія у нашому житті вода
Хімія у нашому житті вода  Оксиды. Номенклатура, классификация, свойства
Оксиды. Номенклатура, классификация, свойства Кислотность органических соединений. Типы химических реакций
Кислотность органических соединений. Типы химических реакций Характеристики химического процесса. Степень превращения, селективность, выход продукта. (Лекция 1.2)
Характеристики химического процесса. Степень превращения, селективность, выход продукта. (Лекция 1.2) Гравиметрический метод анализа
Гравиметрический метод анализа Каталитическая активность ферментов Работу выполнили: Кичаева Нина Иванькова Елена Ученицы 10 класса МОУ Сергиевской СОШ №1 «О
Каталитическая активность ферментов Работу выполнили: Кичаева Нина Иванькова Елена Ученицы 10 класса МОУ Сергиевской СОШ №1 «О (+)-Plumisclerin A. Плюмисклин А
(+)-Plumisclerin A. Плюмисклин А История открытия бензола Впервые бензол описал немецкий химик Иоганн Глаубер. Он получил это соединение в 1649 г. в результате пе
История открытия бензола Впервые бензол описал немецкий химик Иоганн Глаубер. Он получил это соединение в 1649 г. в результате пе Хімічна небезпека: походження, джерела та дії при хімічних забрудненнях
Хімічна небезпека: походження, джерела та дії при хімічних забрудненнях  Обмен железа и его нарушения
Обмен железа и его нарушения Разбор 25 задания. Установим соответствие
Разбор 25 задания. Установим соответствие Соединения галогенов
Соединения галогенов Драгоценные камни Агат, амазонит, кварц, нефрит, оникс, яшма.
Драгоценные камни Агат, амазонит, кварц, нефрит, оникс, яшма. Исследование соединений со структурой слоистого перовскита
Исследование соединений со структурой слоистого перовскита Презентация по Химии "Презентация Ионы и ионная химическая связь" - скачать смотреть
Презентация по Химии "Презентация Ионы и ионная химическая связь" - скачать смотреть  Еріту. Сұйықтықтарды араластыру. Қатты заттарды және сұйықтықтарды бөліп алу
Еріту. Сұйықтықтарды араластыру. Қатты заттарды және сұйықтықтарды бөліп алу Актиний. Нахождение в природе
Актиний. Нахождение в природе Особенности познания в химии
Особенности познания в химии Аммиак
Аммиак Химическая викторина Пятый элемент
Химическая викторина Пятый элемент Химия и организм человека
Химия и организм человека Кремний и его соединения
Кремний и его соединения Структура гетероциклов, нуклеозидов и нуклеотидов
Структура гетероциклов, нуклеозидов и нуклеотидов Аттестационная работа. Образовательная программа элективного курса по химии Химия и мы
Аттестационная работа. Образовательная программа элективного курса по химии Химия и мы