Содержание
- 2. Окислительно-восстановительными реакциями называют реакции, сопровождающиеся изменением степени окисления элементов.
- 3. Почему одни из окислительно - восстановительных протекают, а другие нет? Почему один и тот же окислитель
- 4. Ox + ne ⇔ Red Окисл. Восстан. форма форма Ox и Red взаимосвязаны и это есть
- 5. Общая схема процесса: Ox1+Red2 ⇔ Red1+Ox2 окислитель I+ восстановитель II= восстановитель I + окислитель II Окислительно-восстановительные
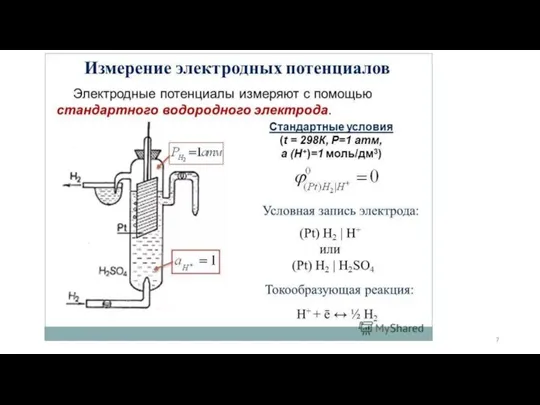
- 6. Стандартный (нормальный) окислительно-восстановительный потенциал пар, которые являются растворимыми формами, - это разница потенциалов, которая возникает между
- 8. Электродвижущая сила ЭДС = Е⁰ок-Е⁰вост ЭДС>0 процесс протекает самопроизвольно в прямом направлении, при ЭДС Чем больше
- 9. Опыт 1. Сравнение химической активности железа и меди. Предварительно обезжиренную и протравленную в соляной кислоте железную
- 10. Сu + FeSO4→ реакция не идет; ∆Е= E(Fe+2\Fe)- E(Cu2+\Cu)= -0,44-0,34= -0,78 В, реакция невозможна, ЭДС‹0 Fe
- 11. Опыт 2. Взаимодействие раствора соли железа (III) с иодидом калия, с бромидом натрия. К подкисленному раствору
- 12. KJ + FeCl3 → FeCl2 + KCl + J2 2J- - 2e → J20 EJ2\2J-= 0,536
- 13. KBr + FeCl3 → 2Br- - 2e → Br20 EBr2\2Br-= 1,065 восстановитель Fe+3 + 1e →
- 14. Задание 1. Какая из приведенных ниже систем будут восстановителем, если в качестве окислителя использовать кислый раствор
- 15. Fe3+ е = Fe2+ Е=0,771 В F2 +2e =2F- Е=2,87 В S +2H+ +2e =H2S Е=0,17
- 16. MnO4- +8H+ +5е =Мn2+ +4Н2О E=1,507 Восстановителем могут быть системы, где электродный потенциал меньше электродного потенциала
- 17. МnО4- + 8Н+ +5е = Мn2++ 4 Н2О в кислой S042- +2Н+ +2е= S032- + Н2О
- 18. Вывод: а)МnО4- + 8Н+ +5е = Мn2++ 4 Н2О E=1,507 B S042- +2Н+ +2е= S032- +
- 19. Все три реакции протекают самопроизвольно, т.к. ЭДС›0. Окислительные свойства иона МпО4- выражены сильнее в кислой среде,
- 20. Опыт 3. Окислительные свойства перманганата калия. В три отдельные пробирки с раствором перманганата калия добавьте разбавленную
- 21. 2KMnO4 + H2O+3Na2SO3= 2MnO2↓ + 2K2SO4 +3Na2SO4+2KOH бурый 2KMnO4 +2 KOH+Na2SO3= 2K2MnO4+Na2SO4+H2O зеленый р-р 2KMnO4 +
- 22. Опыт 4. Влияние среды на окислительно-восстановительный потенциал. В две пробирки внесите дихромат калия (желтого цвета) и
- 23. CrO42- + 2H+ = Cr2O7 2- +H2O желтая оранжевая Cr2O7 2-+ 2OH- = CrO4 2- +
- 24. Cr2O7 2-+ 14H+ +6e = 2Cr3+ + 7H2O E Cr2O72-/ Сr3+ = 1,33B 2J- - 2e
- 25. 2K2CrO4 + H2SO4=К2Cr2O7+ K2SO4 +H2O K2Cr2O7+ 2KOH=2K2CrO4 + H2O K2Cr2O7 + 6KI + 7H2SO4 → 3I2
- 26. Ограничено ли прогнозирование окислительно-восстановительных реакций? Можно ли предсказать точно, будет ли протекать реакция или нет? Можно
- 27. Реакция горения ацетилена: С2Н2 + О2 = 5/2 СО2 + Н2О + 1300 кДж Картина «Вечерний
- 28. Черный порох: +5 0 0 0 +4 -2 2 KNO3 + 3 C + S =
- 30. Скачать презентацию


























 Биопластики: область применения
Биопластики: область применения Эмульсиялардың тұрақтылығына полиэтиленгликоль-баз композицияларының әсері
Эмульсиялардың тұрақтылығына полиэтиленгликоль-баз композицияларының әсері Кристаллография. История развития
Кристаллография. История развития Производство фенолформальдегидной смолы
Производство фенолформальдегидной смолы Обмен липидов. Классификация липидов
Обмен липидов. Классификация липидов Хімічний склад синтетичних миючих засобів та їх основні нормативно-технічні показники
Хімічний склад синтетичних миючих засобів та їх основні нормативно-технічні показники Химия элементов VA группы
Химия элементов VA группы Органические производные титана со связями Ti-O-C. Получение и свойства. Полимеры на их основе
Органические производные титана со связями Ti-O-C. Получение и свойства. Полимеры на их основе Алкины. Ацетилен – представитель алкинов.
Алкины. Ацетилен – представитель алкинов. Презентация по Химии "Основные сведения о строении атома" - скачать смотреть
Презентация по Химии "Основные сведения о строении атома" - скачать смотреть  Кислотность органических соединений. Типы химических реакций
Кислотность органических соединений. Типы химических реакций Эмульсии как лиофобные дисперсные системы
Эмульсии как лиофобные дисперсные системы Альдегиды. Раствор формальдегида. Гексаметилентетрамин (метенамин)
Альдегиды. Раствор формальдегида. Гексаметилентетрамин (метенамин) Нефть. Состав и свойства
Нефть. Состав и свойства «Знаки химических элементов. Относительная атомная масса химических элементов»
«Знаки химических элементов. Относительная атомная масса химических элементов» 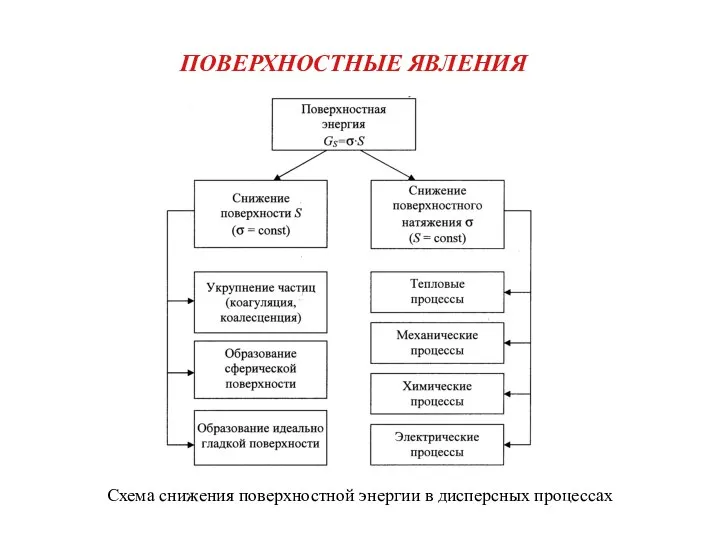 Поверхностные явления
Поверхностные явления Фазовые равновесия в системе ограниченно смешивающихся жидкостей
Фазовые равновесия в системе ограниченно смешивающихся жидкостей Способы разделения смесей
Способы разделения смесей Химические предприятия Саратовской области
Химические предприятия Саратовской области 1oe_zanyatie (1)
1oe_zanyatie (1) Напій кока-кола. Активні інгредієнти кока-коли
Напій кока-кола. Активні інгредієнти кока-коли Адсорбция. Адсорбциондық тепе-теңдік
Адсорбция. Адсорбциондық тепе-теңдік Аминокислоты
Аминокислоты Роль нафти у сучасному світі Підготував учень 11 класу Войтюк Дмитро
Роль нафти у сучасному світі Підготував учень 11 класу Войтюк Дмитро  Новітні досягнення в хімії (9 клас)
Новітні досягнення в хімії (9 клас) Рідкі кристали Використання
Рідкі кристали Використання  Що ховається за цифрами? Харчові домішки
Що ховається за цифрами? Харчові домішки Алканы. Гомологический ряд предельных углеводородов
Алканы. Гомологический ряд предельных углеводородов