Содержание
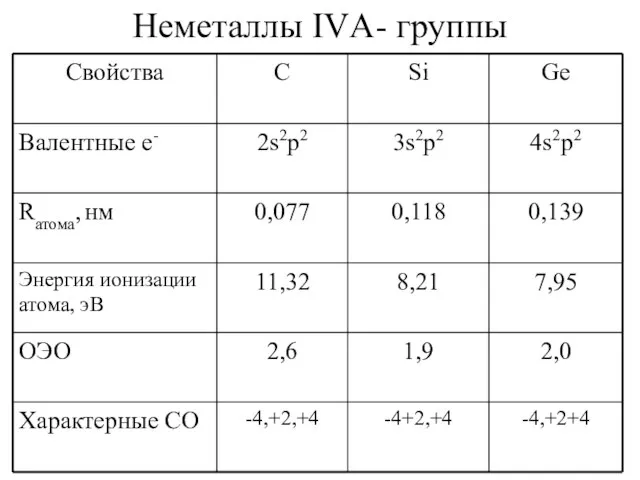
- 2. Неметаллы IVА- группы
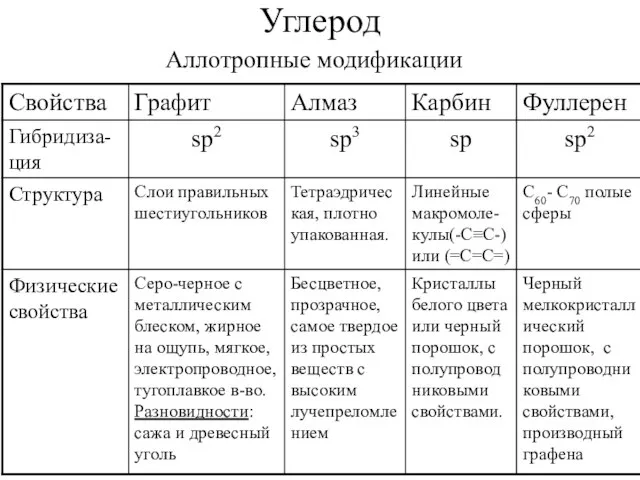
- 3. Углерод Аллотропные модификации
- 4. Схемы строения различных модификаций углерода a: алмаз, b: графит, c: лонсдейлит, d: фуллерен — букибол C60,
- 5. Химические свойства углерода При обычных температурах инертен. При повышенных - проявляет восстановительные и окислительные свойства. Восстановительные
- 6. Окислительные свойства. 1. с Н2 (600оС, р, кат. Pt): C+2H2 = CH4 (метан) 2. образует карбиды
- 7. Соединения углерода СО – оксид углерода (II) –бесцветный газ, тяжелее воздуха, малорастворим в воде, ядовит. Получение:
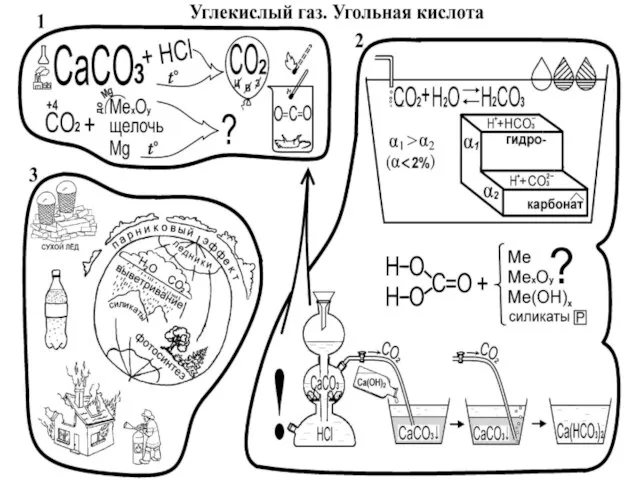
- 8. Соединения углерода +4 CO2- оксид углерода (IV) (углекислый газ) – бесцветный, без запаха, тяжелее воздуха, легко
- 9. Соли угольной кислоты Растворимые карбонаты (гидрокарбонаты, карбонаты щелочных металлов и аммония). подвергаются гидролизу: Na2CO3+H2O=NaHCO3+NaOH CO32- +
- 10. Применение углерода и его соединений Алмазы –в ювелирных изделиях, при бурении скважин алмазными бурами, сверлении металлов,
- 11. Кремний В природе: 90% литосферы – соединения кремния - оксиды, силикаты, алюмосиликаты в составе гранитов, гнейсов,
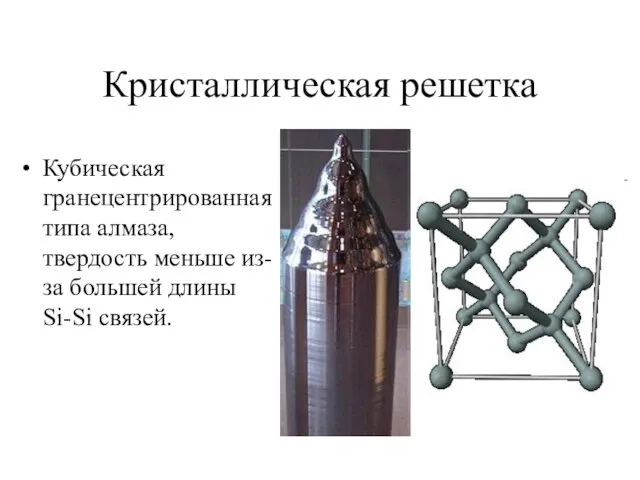
- 12. Кристаллическая решетка Кубическая гранецентрированная типа алмаза, твердость меньше из-за большей длины Si-Si связей.
- 13. Химические свойства кремния Окислитель в р-циях с Ме: Si+2Mg=Mg2Si (силицид магния) Восстановитель в р-циях с Немет:
- 14. Свойства водородных соединений кремния SiH4- моносилан - первый из силанов (SinH2n+2), где n=1-6. Получают косвенно: Mg2Si+2H2SO4=SiH4+2MgSO4
- 15. Кислородные соединения кремния SiO – порошок темно-желтого цвета, изолятор. Получен искусственно восстановлением SiO2 при 1350-1500оС углем:
- 16. SiO2- кремнезем Песок и кварц: горный хрусталь, раух-топаз (окраска - от серого до коричневого), аметист (фиолетовый),
- 17. SiO2 обладает большой твердостью, tпл=1728оС, tкип =2950оС, при охлаждении расплава образуется стекловидная форма. Химически стоек, из
- 18. Кремниевые кислоты и их соли nSiO2·mH2O –кислоты слабые, малорастворимые. H2SiO3 - метакремниевая кислота полимеризуется из пересыщенных
- 19. Стекло, керамика, цемент Стекло – прозрачные аморфные сплавы, не имеющие четких температур плавления и затвердевания. Оконное
- 20. Бор Электронное строение валентного уровня: 2s2p1. C.O. : +3 (BF3,B2O3), -3 (Mg3B2, B3H6) Аллотропические модификации: 1)
- 21. Химические свойства бора При обычных условиях инертен: не взаимодействует с H2O, HГал к-тами. Кислоты-окислители окисляют его
- 22. Получение и применение бора Аморфный : 3Mg+B2O3=t 2B +3MgO Кристаллический: 2 BBr3+3H2=t 2B+6HBr Применение: легирование сплавов
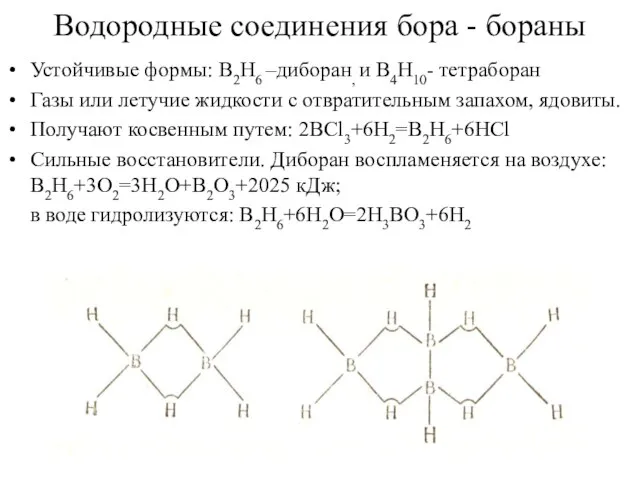
- 23. Водородные соединения бора - бораны Устойчивые формы: B2H6 –диборан, и B4H10- тетраборан Газы или летучие жидкости
- 24. Кислородные соединения бора В2О3 – оксид бора, бесцветное кристаллическое вещество, при охлаждении расплава переходит в стеклообразное
- 25. Бораты, бориды Соли тетраборной кислоты (H2B4O7), неизвестной в свободном состоянии: 4H3BO3+2NaOH=Na2B4O7+7H2O подвержены гидролизу: Na2B4O7+3H2O=2NaBO2+2H3BO3 Cr4B, CrB,
- 26. BN – нитрид бора - белый порошок, огнеупорный, расслаивается на чешуйки, химически инертен, с кристаллической структурой
- 29. Скачать презентацию





















 Алюминий и его соединения
Алюминий и его соединения Использование QR-кода в обучении химии
Использование QR-кода в обучении химии Органические вяжущие. Битумы
Органические вяжущие. Битумы Гидролиз солей
Гидролиз солей Презентация по дисциплине «Химия» по теме: «Нефть, состав и свойства. Переработка нефти. Нефтепродукты, их применение.» студентк
Презентация по дисциплине «Химия» по теме: «Нефть, состав и свойства. Переработка нефти. Нефтепродукты, их применение.» студентк Молекулы. Свойства молекул
Молекулы. Свойства молекул Хімічні мутагени
Хімічні мутагени  Электролизные установки
Электролизные установки Строение ядра
Строение ядра Презентация Фосфор 9 класс
Презентация Фосфор 9 класс Оксиды
Оксиды  Растворы, классификация растворов
Растворы, классификация растворов Азот
Азот Нефть. Состав. Свойства. Переработка
Нефть. Состав. Свойства. Переработка Колообіг Карбону в природі Оленченко Катерина, 11-Б
Колообіг Карбону в природі Оленченко Катерина, 11-Б  Презентация по Химии "Апатит" - скачать смотреть
Презентация по Химии "Апатит" - скачать смотреть  Гідроліз солей
Гідроліз солей Регуляция трансляции. Посттрансляционные модификации белков. (Лекция 9)
Регуляция трансляции. Посттрансляционные модификации белков. (Лекция 9) Бериллий (Beryllium) Be
Бериллий (Beryllium) Be Презентация по химии Хлор
Презентация по химии Хлор алмаз
алмаз Бытовая химия в нашей жизни
Бытовая химия в нашей жизни ОВР в органической химии Автор: Тятин Павел Владимирович, 11М класс, МОУ лицей №6 Руководитель: Дробот Светлана Сергеевна , учит
ОВР в органической химии Автор: Тятин Павел Владимирович, 11М класс, МОУ лицей №6 Руководитель: Дробот Светлана Сергеевна , учит Бутан как хладагент
Бутан как хладагент “Физикалық химия” курсы бойынша жеке бағдарланған индивидуалды зерттеу жұмысы
“Физикалық химия” курсы бойынша жеке бағдарланған индивидуалды зерттеу жұмысы Разработка проектных решений по переводу паровых котлов электростанций в конденсационный режим с целью увеличения кпд котла
Разработка проектных решений по переводу паровых котлов электростанций в конденсационный режим с целью увеличения кпд котла Презентация по Химии "Гидролиз солей" - скачать смотреть бесплатно
Презентация по Химии "Гидролиз солей" - скачать смотреть бесплатно Растворы и процессы, проходящие в растворах. Протолитическая теория кислот и оснований
Растворы и процессы, проходящие в растворах. Протолитическая теория кислот и оснований