Содержание
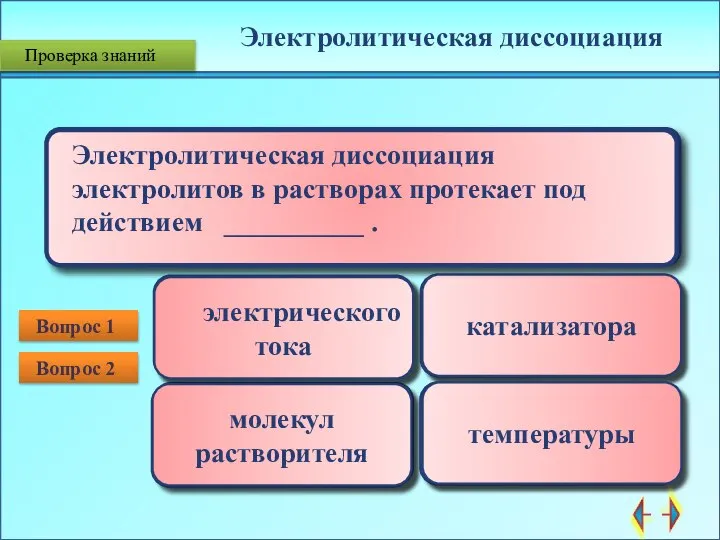
- 2. атомы ионы молекулы электроны Электролитическая диссоциация в растворах – это процесс распада электролита на __________ .
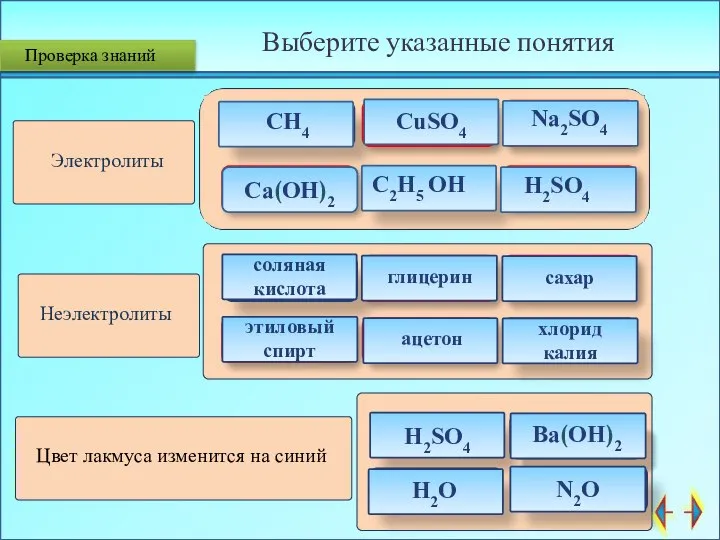
- 3. Ca(OH)2 Электролиты Неэлектролиты Неверно Молодец Молодец Неверно Молодец Молодец Выберите указанные понятия Неверно Цвет лакмуса изменится
- 4. HNO3 Cильные кислоты Сильные основания Неверно Молодец Молодец Неверно Молодец Молодец Неверно Диссоциация по трем ступеням
- 5. Проверка знаний рН [H+] [H+] ↔ [OH-] нейтральная кислая щелочная [H+] = [OH-] [H+] > [OH-]
- 6. Что такое гидролиз? Гидролиз соли – процесс ионообменного взаимодействия ионов соли с молекулами воды, в результате
- 7. Сущность процесса гидролиза солей Возможно три типа гидролиза: гидролиз по катиону (в реакцию с водой вступает
- 8. Типы гидролиза
- 9. Гидролиз солей, образованных слабым основанием и сильной кислотой. NH4NO3 NH4+ NO3– H2O O H – +
- 10. NH4NO3 Уравнение реакции гидролиза нитрата аммония NH4NO3 H2O + NH4OH + HNO3 В ионной форме: NH4+
- 11. Гидролиз карбоната натрия Na2CO3. В водном растворе: Ионы CO32- и H+ связываются, образуя слабую малодиссоциированную угольную
- 12. Na2CO3 + H2O NaHCO3 + CO32- + 2Na+ + H2O Na+ + HCO3- + Na+ +
- 13. NaCl NaOH Na + Na+ HOH OH- (pH = 7) NaCl + HOH гидролизу подвергаться не
- 14. CH3COONH4 CH3COO– + NH4+ H2O O H– H+ + Гидролиз солей, образованных слабым основанием и слабой
- 15. Реакция раствора соли CH3COONH4 – нейтральная (рН=7), потому что Кдис.(NH4OH) = Кдис.(CH3COOH) (Кдис.NH4OH =1.8∙10-5; Кдис.CH3COOH =1.8∙10-5).
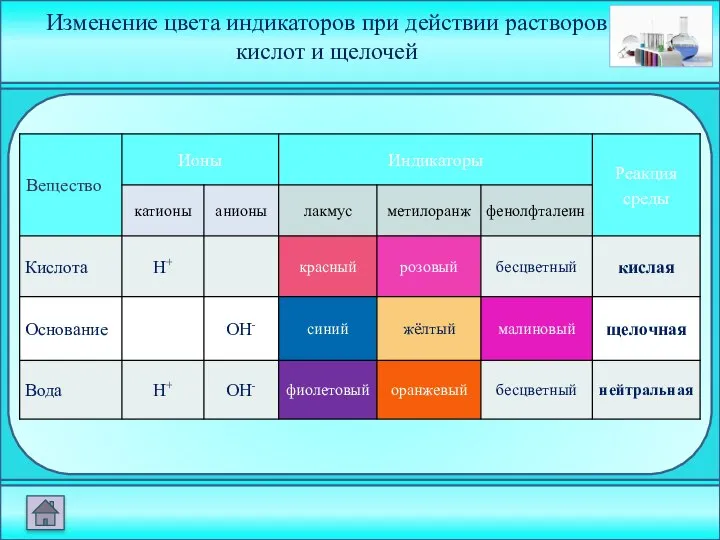
- 16. Изменение цвета индикаторов при действии растворов кислот и щелочей
- 17. Многоосновная ортофосфорная кислота Н3РО4 в растворе диссоциирует по трем ступеням: I ступень: H3PO4 ⮀ H+ +
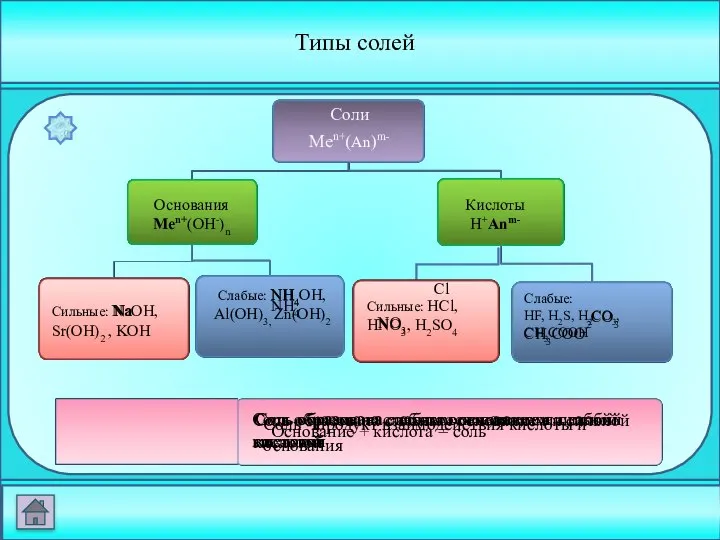
- 18. – ?1 Типы солей Сильные: HCl, HNO3, H2SO4 Сильные: NaOH, Sr(OH)2 , KOH Основания Men+(OH-)n Кислоты
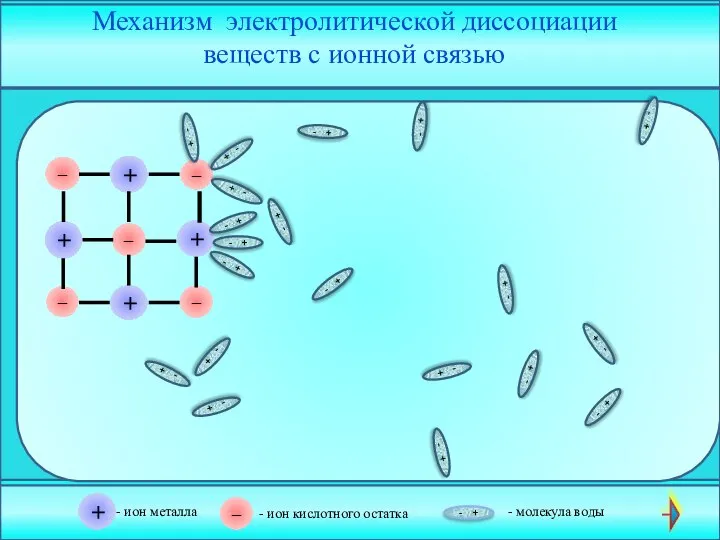
- 19. + – + + + – – – – - + + – - ион металла
- 21. Скачать презентацию

![Проверка знаний рН [H+] [H+] ↔ [OH-] нейтральная кислая щелочная [H+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1272349/slide-4.jpg)











 Контрольная работа. Разбор. 9 класс
Контрольная работа. Разбор. 9 класс Цинк. Знаходження в періодичній системі і основні характеристики
Цинк. Знаходження в періодичній системі і основні характеристики Органическая химия. Алифатические углеводороды
Органическая химия. Алифатические углеводороды Получение и приминение этилена
Получение и приминение этилена Презентация по Химии "Почему золото блестит?" - скачать смотреть
Презентация по Химии "Почему золото блестит?" - скачать смотреть  Химия элементов. Лекция 6 Комплексные соединения: типы и классификация. Методы получения и разрушения. Решение задач.
Химия элементов. Лекция 6 Комплексные соединения: типы и классификация. Методы получения и разрушения. Решение задач. 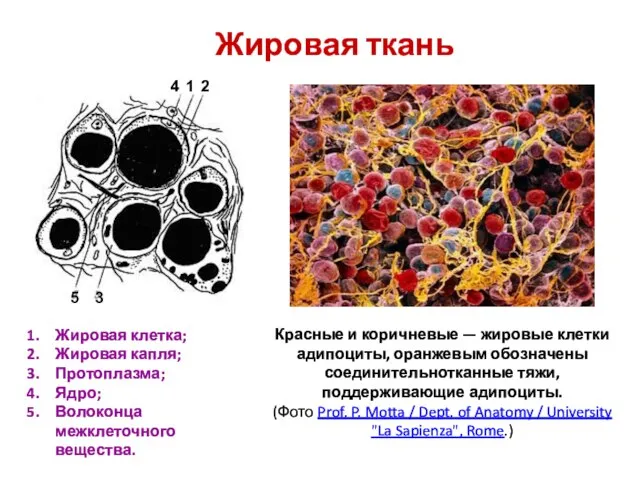 Жировая ткань
Жировая ткань Зависимость константы скорости химической реакции от температуры
Зависимость константы скорости химической реакции от температуры История микроскопа
История микроскопа  Изучение влияния азотсодержащих удобрений на качество продукции по содержанию нитратов
Изучение влияния азотсодержащих удобрений на качество продукции по содержанию нитратов Клиническая фармакология антибактериальных препаратов
Клиническая фармакология антибактериальных препаратов Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Химический элемент натрий
Химический элемент натрий Ковалентная химическая связь
Ковалентная химическая связь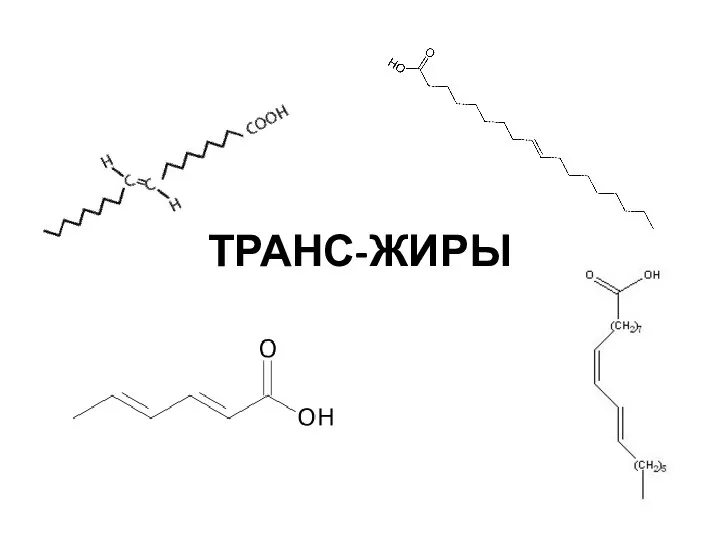 Транс-жиры
Транс-жиры Обмен липидов
Обмен липидов Метаболизм углеводов
Метаболизм углеводов Добрый день! Учитель химии МКОУ СОШ №2 им.Ж.И. Алферова г.Туринска Кузнецова Т.В.
Добрый день! Учитель химии МКОУ СОШ №2 им.Ж.И. Алферова г.Туринска Кузнецова Т.В. Роль минеральных веществ в организме человека
Роль минеральных веществ в организме человека Водородная связь
Водородная связь Разделение смесей
Разделение смесей Подготовка к ЕГЭ: КИСЛОРОДСОДЕРЖАЩИЕ. УГЛЕВОДЫ. Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразоват
Подготовка к ЕГЭ: КИСЛОРОДСОДЕРЖАЩИЕ. УГЛЕВОДЫ. Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразоват Дисперсные системы и растворы
Дисперсные системы и растворы Периодическая система химических элементов Д.И.Менделеева Учитель химии МБОУ СОШ №37 г. Шахты Ростовской области Вабищевич М.В.
Периодическая система химических элементов Д.И.Менделеева Учитель химии МБОУ СОШ №37 г. Шахты Ростовской области Вабищевич М.В. Mineralogy. Chemical composition and properties of minerals
Mineralogy. Chemical composition and properties of minerals Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования
Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования Соли. Названия и классификация солей
Соли. Названия и классификация солей