Содержание
- 2. Обменными принято называть реакции, в которых реагирующие молекулы и ионы, сталкиваясь, передают друг другу какие-либо частицы
- 3. Необратимый обменные реакции Если слабый электролит или газ присутствует только в продуктах реакции, реакция необратимо протекает
- 4. Обратимые обменные реакции Если слабый электролит или газ присутствует как в исходных веществах, так и в
- 5. 10.2. Гидролиз Гидролиз – это взаимодействия вещества с водой, при кото-ром составные части вещества соединяются с
- 6. 2) Соли, образованные сильным основанием и слабой кислотой: Na2CO3+H2O⇄ 2Na+ + CO32-+HOH ⇄ H2CO3 ⇄ H++HCO3-
- 7. 4) Соли, образованные слабым основанием и слабой кислотой: (NH4)2S + 2H2O⇄ 2NH4+ + S2- +2HOH⇄ 2NH4OH+H2S
- 8. 10.2.2. Количественные характеристики процесса гидролиза солей 1.Равновесие процесса гидролиза характеризуется константой гидролиза Кг: а) Соль образована
- 9. б) Соль образована сильным основанием и слабой кислотой: в) Соль образована слабым основанием и слабой кислотой:
- 10. 10.2.3. Влияние концентрации соли на процесс гидролиза. По мере разбавления раствора степень гидролиза возрастает 10.2.3. Влияние
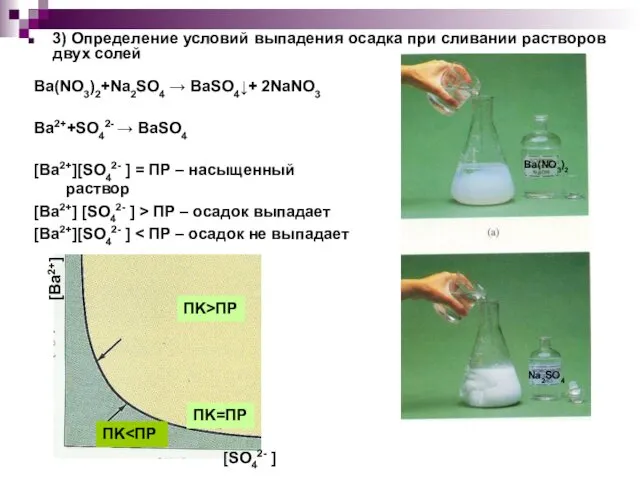
- 11. 10.3. реакции с образованием осадков. Произведение растворимости Ba(NO3)2+Na2SO4 → BaSO4↓+ 2NaNO3 В насыщенном растворе: BaSO4 кр
- 12. Практическое использование величины ПР 1) вычисление величины растворимости (s) соли: BaSO4 кр ⇄ Ba2++SO42- s s
- 13. 2) Последовательное (дробное) осаждение солей из раствора Раствор: CaCl2 BaCl2 SrCl2 По каплям добавляем H2SO4 Получаем:
- 14. 3) Определение условий выпадения осадка при сливании растворов двух солей Ba(NO3)2+Na2SO4 → BaSO4↓+ 2NaNO3 Ba2++SO42- →
- 15. KHC2O4 + CaSO4 = CaC2O4↓ + KHSO4 ПР=1,3 10-4 ПР=2 10-9
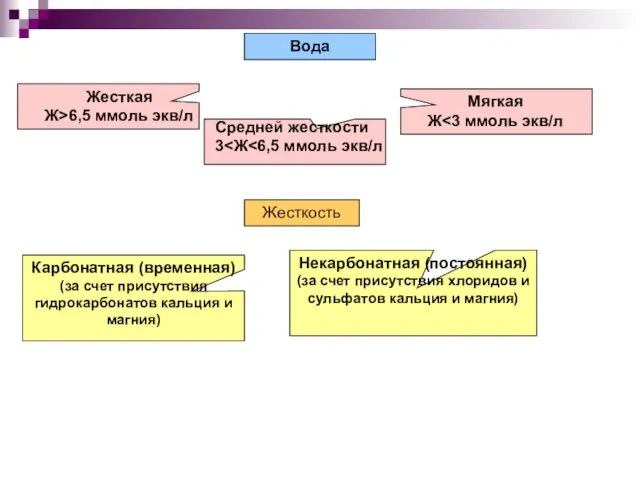
- 16. 10.4. Жесткость природных вод Природные воды, содержащие в растворе большое количество солей кальция и магния называются
- 17. Жесткость Карбонатная (временная) (за счет присутствия гидрокарбонатов кальция и магния) Некарбонатная (постоянная) (за счет присутствия хлоридов
- 18. Система водоподготовки 1. Освобождение от грубодисперсных примесей (отстой, фильтрация) 2. Защелачивание (до рН 6,5-7,5). Цель –
- 20. Скачать презентацию















 Хиральные производные тиомочевины и скуарамидов в асимметрическом катализе
Хиральные производные тиомочевины и скуарамидов в асимметрическом катализе Кислоты. Химические свойства
Кислоты. Химические свойства Алюминий. Природные соединения алюминия
Алюминий. Природные соединения алюминия Теория электролитической диссоциации. Протолитическая теория кислот и оснований
Теория электролитической диссоциации. Протолитическая теория кислот и оснований Читаем формулы, определяем класс неорганических веществ. Называем вещества
Читаем формулы, определяем класс неорганических веществ. Называем вещества Комплексні сполуки
Комплексні сполуки  Алюминий, его физические и химические свойства
Алюминий, его физические и химические свойства Минералы и их классификация
Минералы и их классификация Химическое оружие кожнонарывного действия
Химическое оружие кожнонарывного действия Презентация Химия в сельском хозяйстве
Презентация Химия в сельском хозяйстве Техника безопасности
Техника безопасности Plastics. General characteristics. Classification. Composition. The main types of plastics, their appointment
Plastics. General characteristics. Classification. Composition. The main types of plastics, their appointment Презентация по Химии "Синтетические моющие средства." - скачать смотреть бесплатно_
Презентация по Химии "Синтетические моющие средства." - скачать смотреть бесплатно_ Презентация по Химии "Мыла и моющие средства" - скачать смотреть бесплатно
Презентация по Химии "Мыла и моющие средства" - скачать смотреть бесплатно Кремний. Химические свойства
Кремний. Химические свойства Металлы. Физические и химические свойства
Металлы. Физические и химические свойства Алкилирование изобутана олефинами
Алкилирование изобутана олефинами Производные индола
Производные индола Геохимия гранитоидов, зоны гипергенеза, осадочного процесса
Геохимия гранитоидов, зоны гипергенеза, осадочного процесса Классификация химических реакций
Классификация химических реакций Задачи, решаемые специализированными ТВ системами
Задачи, решаемые специализированными ТВ системами Приготовили Прожеева Н, Казаченко Л.
Приготовили Прожеева Н, Казаченко Л. Белки. Структуры белков
Белки. Структуры белков Использование углеводородов в медицине
Использование углеводородов в медицине Решение задач на концентрацию при подготовке к ГИА
Решение задач на концентрацию при подготовке к ГИА Химическая коррозия
Химическая коррозия Химические процессы зоны гипергенеза
Химические процессы зоны гипергенеза Автомобильные трансмиссионные масла
Автомобильные трансмиссионные масла