Содержание
- 2. План 1. Загальні відомості про комплексні сполуки. 2. Координаційні числа d-елементів. 3. Стабільність комплексів d-елементів.
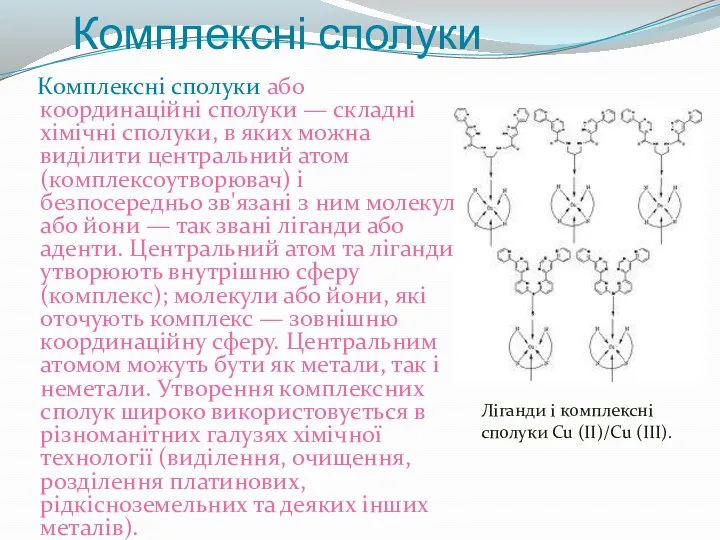
- 3. Комплексні сполуки Комплексні сполуки або координаційні сполуки — складні хімічні сполуки, в яких можна виділити центральний
- 4. Загальні відомості про комплексні сполуки Хімія комплексних сполук є однією з галузей сучасної хімії, що інтенсивно
- 5. За Ф. Коттоном і Дж. Уїлкінсоном дане визначення комплексних сполук потребує деяких уточнень: -по-перше, комплексоутворювач і
- 6. Отже, класичне визначення комплексних сполук потребує доповнень: Комплексні сполуки — це сполуки, до складу яких входять
- 7. Приведене вище визначення вказує, що, наприклад, такі частинки як CH4, SO42-, NO3- та інші недоцільно представляти
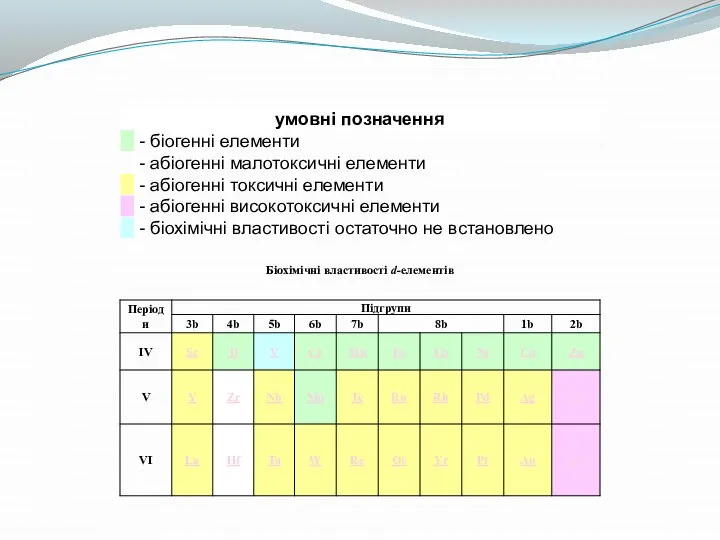
- 8. Координаційні числа d-елементів Найбільш характерними координаційними числами d-елементів є 4 і 6 (наприклад: [Pt(NH3)4]Cl2, К2[Ni(CN)4], К4[Fe(CN)6],
- 9. Стабільність комплексів d-елементів Серед монодентантних лігандів найбільш стабільні комплекси з d-елементами утворюють ціанід-йон, аміак, галогенід-йони і
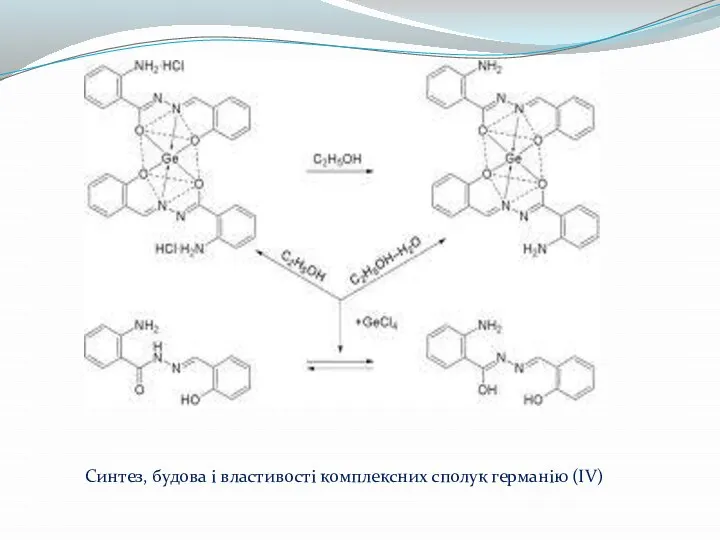
- 11. Синтез, будова і властивості комплексних сполук германію (IV)
- 13. Скачать презентацию







 Геолого-промышленные типы месторождений полезных ископаемых
Геолого-промышленные типы месторождений полезных ископаемых Степень окисления Химия 8 класс
Степень окисления Химия 8 класс Презентация по Химии "ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ" - скачать смотреть бесплатно
Презентация по Химии "ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ" - скачать смотреть бесплатно Растворы коллоидных поверхностно-активных веществ (ПАВ)
Растворы коллоидных поверхностно-активных веществ (ПАВ) Презентация по Химии "Степень окисления. Составление химических формул бинарных соединений" - скачать смотреть
Презентация по Химии "Степень окисления. Составление химических формул бинарных соединений" - скачать смотреть  Підготувала учениця 11-А класу Білецька Олеся
Підготувала учениця 11-А класу Білецька Олеся  Способы получения металлов. (11 класс)
Способы получения металлов. (11 класс) Осветлённая вода системы гидрозолоудаления
Осветлённая вода системы гидрозолоудаления Производные ксантина (дипрофиллин, ксантинола никотинат, пентоксифиллин) и гедантоина (фенитоин)
Производные ксантина (дипрофиллин, ксантинола никотинат, пентоксифиллин) и гедантоина (фенитоин) Простейшие операции с веществом
Простейшие операции с веществом Общая фармакология
Общая фармакология Энергетика и направление химических реакций
Энергетика и направление химических реакций Классификация химических реакций
Классификация химических реакций Углеводороды. Обобщение знаний
Углеводороды. Обобщение знаний Термодинамические свойства дисперсных систем
Термодинамические свойства дисперсных систем Характерные дефекты в монокристаллах кремния и их влияние на свойства. Методы диагностики
Характерные дефекты в монокристаллах кремния и их влияние на свойства. Методы диагностики Лед – как состояние воды
Лед – как состояние воды Поверхностные явления и дисперсные системы (коллоидная химия)
Поверхностные явления и дисперсные системы (коллоидная химия) Геохимия литосферы
Геохимия литосферы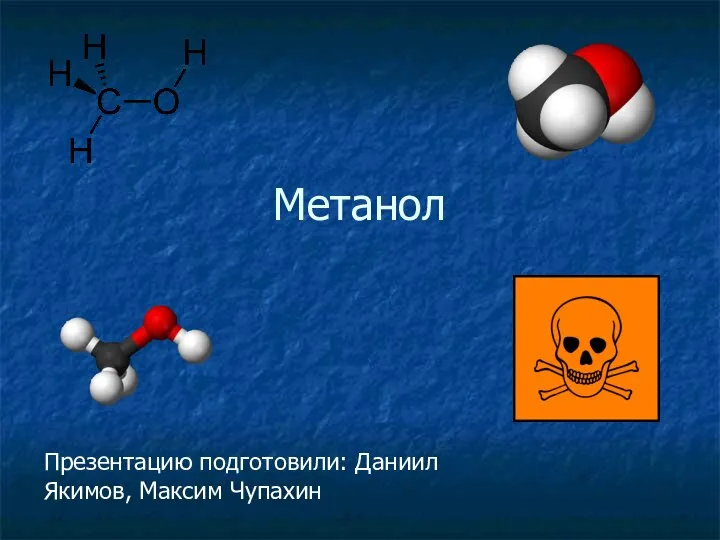 Метанол. Краткая характеристика
Метанол. Краткая характеристика Железо-углеродистые сплавы
Железо-углеродистые сплавы Методы исследования комплексообразования. Леция 2
Методы исследования комплексообразования. Леция 2 Вода - растворитель. Растворы
Вода - растворитель. Растворы Теория строения органических соединений
Теория строения органических соединений Коррозия металлов
Коррозия металлов Особенности химии фтора
Особенности химии фтора Філософія державного контролю якості лікарських засобів. Міжнародний досвід управління якістю у фармацевтичній галузі
Філософія державного контролю якості лікарських засобів. Міжнародний досвід управління якістю у фармацевтичній галузі Химия и охрана окружающей среды
Химия и охрана окружающей среды