Содержание
- 2. ФЕРМЕНТЫ (ЭНЗИМЫ) – СОЕДИНЕНИЯ БЕЛКОВОЙ ПРИРОДЫ, СПОСОБНЫЕ КАТАЛИТИЧЕСКИ УСКОРЯТЬ ПРОТЕКАНИЕ ХИМИЧЕСКИХ РЕАКЦИЙ Значение для изучения: Ферменты
- 3. Сходство ферментов с небиологическими катализаторами заключается в том, что: Небиологические катализаторы и энзимы ускоряют энергетически возможные
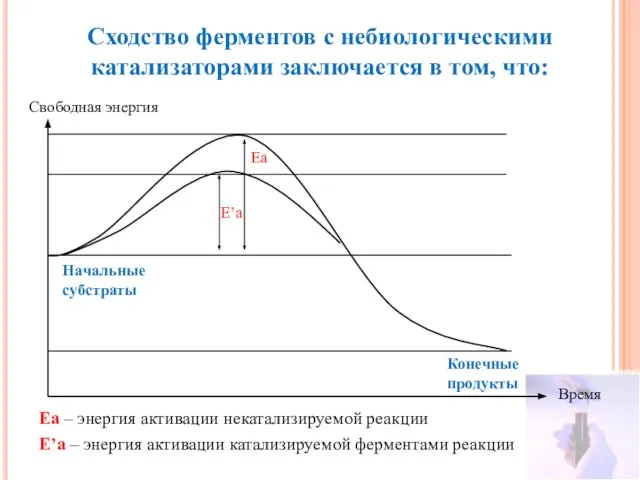
- 4. Сходство ферментов с небиологическими катализаторами заключается в том, что: Свободная энергия Время Конечные продукты Начальные субстраты
- 5. Сходство ферментов с небиологическими катализаторами заключается в том, что: В ходе катализа направление реакции не изменяется;
- 6. Отличия ферментов от небиологических катализаторов (основные свойства) Скорость ферментативных реакций значительно выше; Ферменты обладают высокой специфичностью
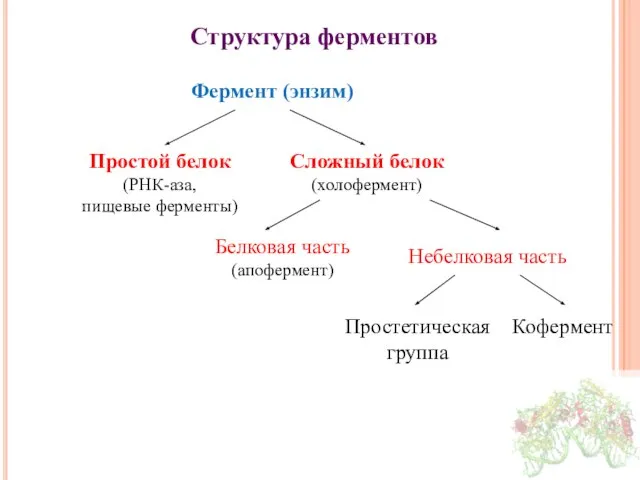
- 7. Структура ферментов Фермент (энзим) Простой белок (РНК-аза, пищевые ферменты) Сложный белок (холофермент) Белковая часть (апофермент) Небелковая
- 8. Небелковая часть Производные витаминов Гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы и являющиеся простетической
- 9. Функции небелковой части фермента Перенос атомов водорода, электронов (окислительно-восстановительные реакции – НАД, ФАД и др.). Перенос
- 10. Активные центры ферментов Субстратный Каталитический Аллостерический Закономерности в построении активных центров 1. В построении активных центров
- 11. Активные центры ферментов Субстратный Каталитический Аллостерический Закономерности в построении активных центров 4. Если фермент является олиго-
- 12. Схема строения активного центра фермента
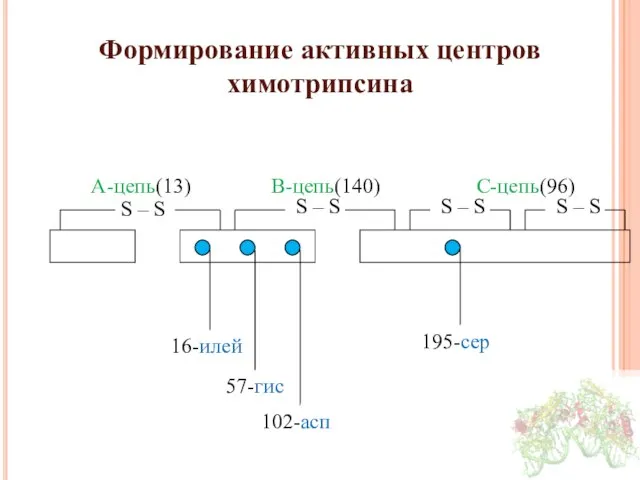
- 13. Формирование активных центров химотрипсина А-цепь(13) В-цепь(140) С-цепь(96) 16-илей 57-гис 102-асп 195-сер
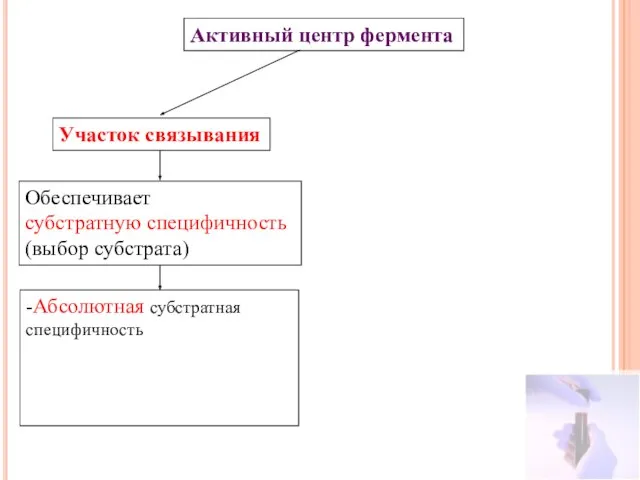
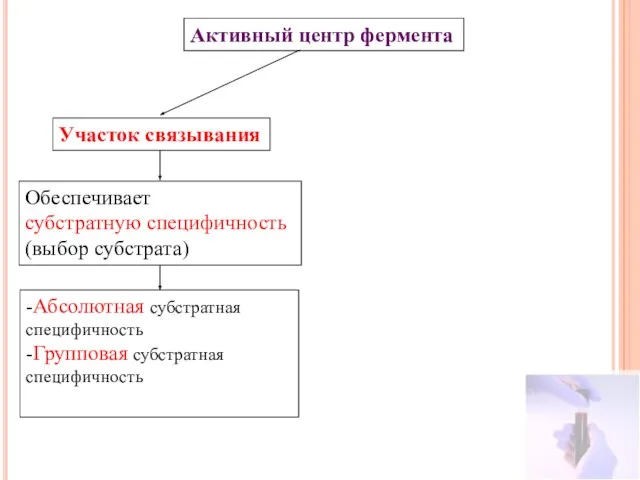
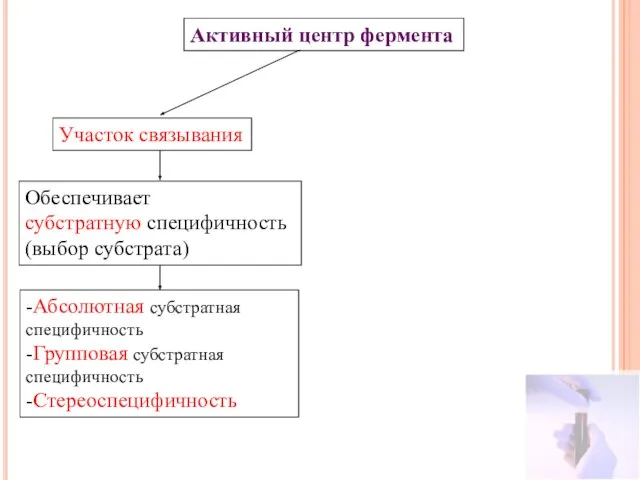
- 14. Активный центр фермента Участок связывания Обеспечивает субстратную специфичность (выбор субстрата) -Абсолютная субстратная специфичность -Групповая субстратная специфичность
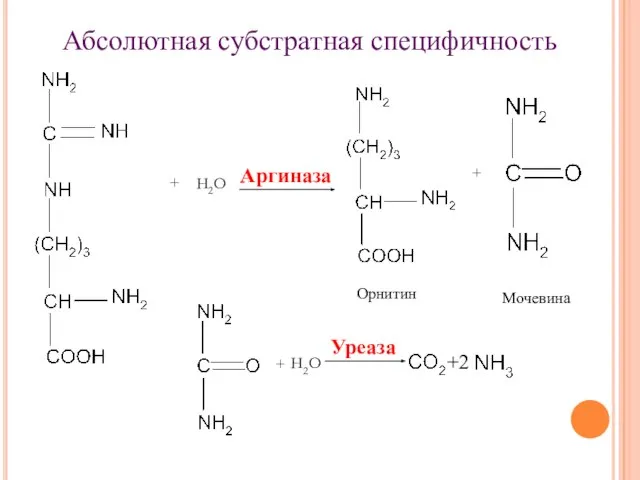
- 15. + Абсолютная субстратная специфичность Аргиназа Орнитин + Мочевина + Уреаза +2 Н2О Н2О
- 16. Активный центр фермента Участок связывания Обеспечивает субстратную специфичность (выбор субстрата) -Абсолютная субстратная специфичность -Групповая субстратная специфичность
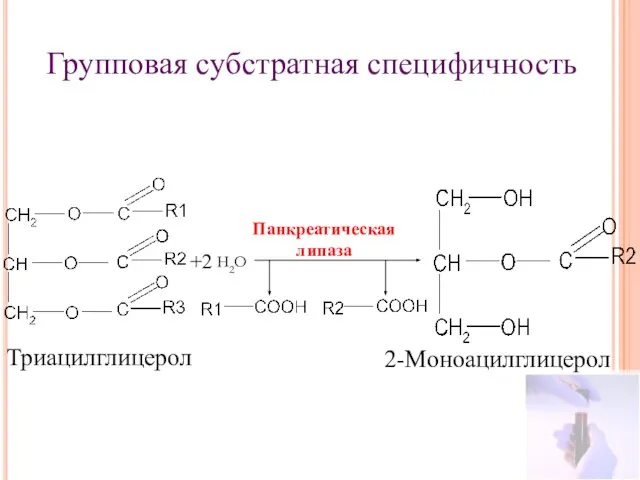
- 17. Групповая субстратная специфичность +2 Триацилглицерол 2-Моноацилглицерол Панкреатическая липаза Н2О
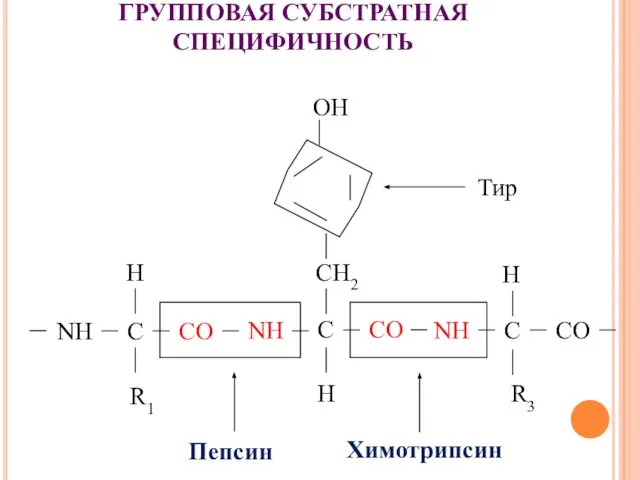
- 18. ГРУППОВАЯ СУБСТРАТНАЯ СПЕЦИФИЧНОСТЬ Пепсин - NH2 (фен, тир, три, глу, асп) Трипсин - СООH (лиз, арг)
- 19. ГРУППОВАЯ СУБСТРАТНАЯ СПЕЦИФИЧНОСТЬ Тир Пепсин Химотрипсин
- 20. Активный центр фермента Участок связывания Обеспечивает субстратную специфичность (выбор субстрата) -Абсолютная субстратная специфичность -Групповая субстратная специфичность
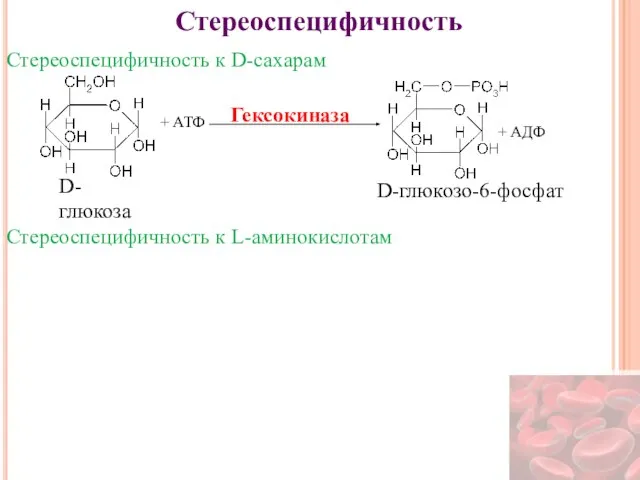
- 21. Стереоспецифичность Стереоспецифичность к D-сахарам + АТФ + АДФ Гексокиназа D-глюкоза D-глюкозо-6-фосфат Стереоспецифичность к L-аминокислотам
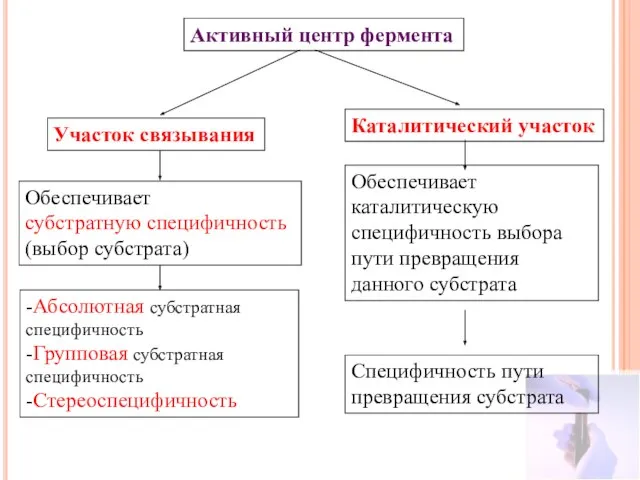
- 22. Активный центр фермента Участок связывания Каталитический участок Обеспечивает субстратную специфичность (выбор субстрата) -Абсолютная субстратная специфичность -Групповая
- 23. КАТАЛИТИЧЕСКАЯ СПЕЦИФИЧНОСТЬ Каталитические пути превращения глюкозо-6-фосфата
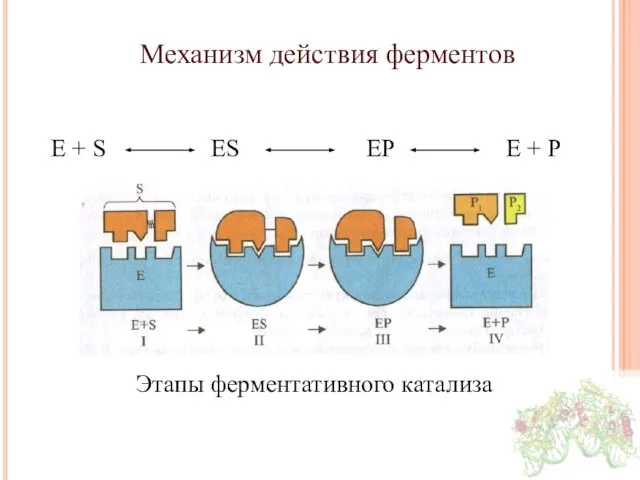
- 24. Механизм действия ферментов Е + S ЕS ЕP Е + P Этапы ферментативного катализа
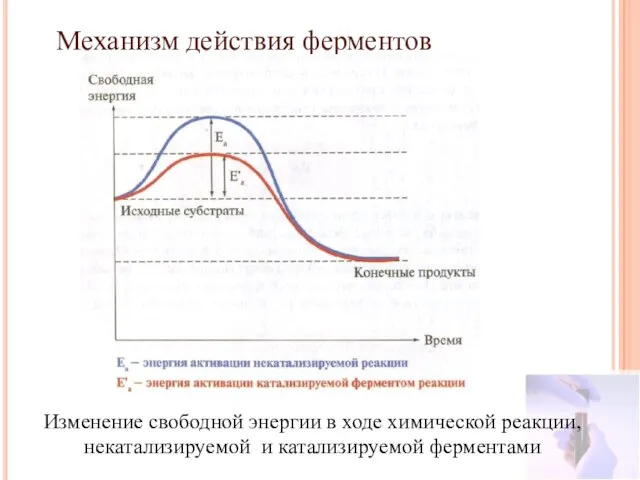
- 25. Механизм действия ферментов Изменение свободной энергии в ходе химической реакции, некатализируемой и катализируемой ферментами
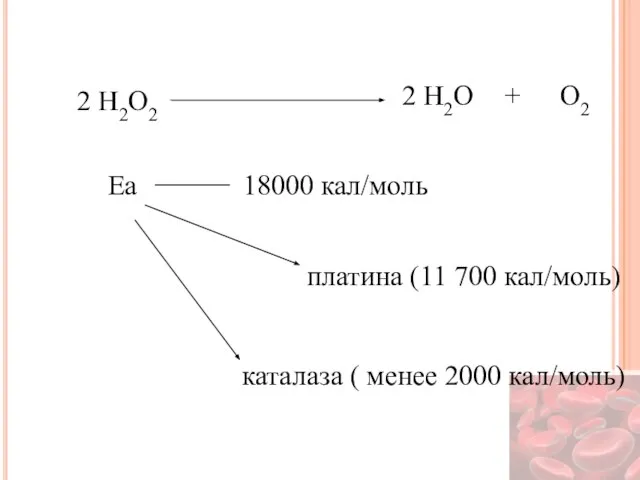
- 26. 2 H2O2 2 H2O O2 + Еа 18000 кал/моль платина (11 700 кал/моль) каталаза ( менее
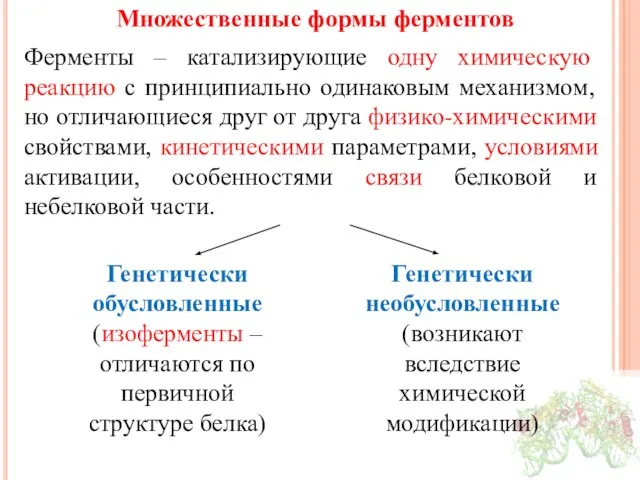
- 27. Множественные формы ферментов Ферменты – катализирующие одну химическую реакцию с принципиально одинаковым механизмом, но отличающиеся друг
- 28. Реакция, катализируемая лактатдегидрогеназой (ЛДГ)
- 30. Скачать презентацию












 Неорганические вещества
Неорганические вещества Аттестационная работа. Программа элективного курса химия и военное дело. (8-9 класс)
Аттестационная работа. Программа элективного курса химия и военное дело. (8-9 класс) ПРОЕКТ по химии «Значение химии в жизни человека» Выполнила ученица 8 А класса МОУ «Ленинская СОШ №3» Кальнова Дарья
ПРОЕКТ по химии «Значение химии в жизни человека» Выполнила ученица 8 А класса МОУ «Ленинская СОШ №3» Кальнова Дарья Краткая история химии
Краткая история химии Процессы комплексообразования
Процессы комплексообразования Воздух, которым мы дышим
Воздух, которым мы дышим Хлороводород. Соляная кислота.
Хлороводород. Соляная кислота.  Химический элемент - бром
Химический элемент - бром Шампунь для волосся
Шампунь для волосся  Химия элементов VIIA-группы
Химия элементов VIIA-группы Конструкционные функциональные волокнистые композиты. Полимерные матричные материалы
Конструкционные функциональные волокнистые композиты. Полимерные матричные материалы Мило та його склад
Мило та його склад  Фiзико-хімічні основи розвитку пожеж. Тепломасообмін, температурний режим пожежі в огородженні. (Розділ 4.13.5)
Фiзико-хімічні основи розвитку пожеж. Тепломасообмін, температурний режим пожежі в огородженні. (Розділ 4.13.5) Характеристика и технология производства основных катализаторов нефтепереработки
Характеристика и технология производства основных катализаторов нефтепереработки Геохимия магматического процесса
Геохимия магматического процесса Химия в сельском хозяйстве
Химия в сельском хозяйстве Поверхностные и массовые силы. Вывод уравнения неразрывности сплошной однокомпонентной среды
Поверхностные и массовые силы. Вывод уравнения неразрывности сплошной однокомпонентной среды Бензол қатарындағы гетерофункционалды туындылары дәрі-дәрмек ретінде
Бензол қатарындағы гетерофункционалды туындылары дәрі-дәрмек ретінде Основы химической термодинамики и кинетики химических реакций
Основы химической термодинамики и кинетики химических реакций Бораттарды алу
Бораттарды алу Глюкоза. Будова глюкози та її властивості
Глюкоза. Будова глюкози та її властивості Автор: Васильева Е.Д. Учитель физики МОУ гимназия г.Советский
Автор: Васильева Е.Д. Учитель физики МОУ гимназия г.Советский Глобальні екологічні проблеми повязані з добуванням та переробкою вуглеводної сировини Підготувала учениця 11-А класу Гребі
Глобальні екологічні проблеми повязані з добуванням та переробкою вуглеводної сировини Підготувала учениця 11-А класу Гребі Основные понятия химической термодинамики. Первый закон термодинамики Физическая и коллоидная химия и ее значение для фармации
Основные понятия химической термодинамики. Первый закон термодинамики Физическая и коллоидная химия и ее значение для фармации Каталитические превращения углеводородов и других компонентов нефти
Каталитические превращения углеводородов и других компонентов нефти Синтез метилового эфира цинкофорина
Синтез метилового эфира цинкофорина Количество вещества. Моль. Молярная масса
Количество вещества. Моль. Молярная масса Крахмал. Строение вещества
Крахмал. Строение вещества