Содержание
- 2. Классификация гидроксидов и оксидов алюминия Гидроксиды алюминия Модификации тригидроксида алюминия Al(OH)3: наиболее часто встречаются гиббсит (гидраргиллит),
- 3. Оксиды алюминия Основные кристаллические фазы Al2O3: α, χ, γ, δ, η, θ и др. Низкотемпературные оксиды,
- 4. Получение гидроксида алюминия на глиноземных заводах Сырье для производства тригидрата алюминия - боксит А1(ОН)3 и нефелин
- 5. Получение гидроксида алюминия переосаждением тригидрата Алюминатный метод. Тригидрат алюминия растворяют в щелочи: Al(OH)3 + NaOH +
- 6. Получение гидроксида алюминия гидролизом алкоголятов CONDEA (в настоящее время SASOL) Синтез триэтилалюминия Al + 1/2H2 +
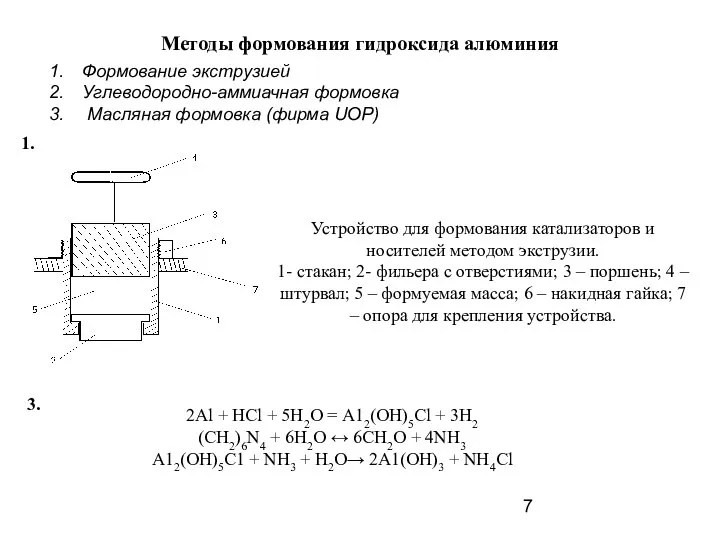
- 7. Методы формования гидроксида алюминия Устройство для формования катализаторов и носителей методом экструзии. 1- стакан; 2- фильера
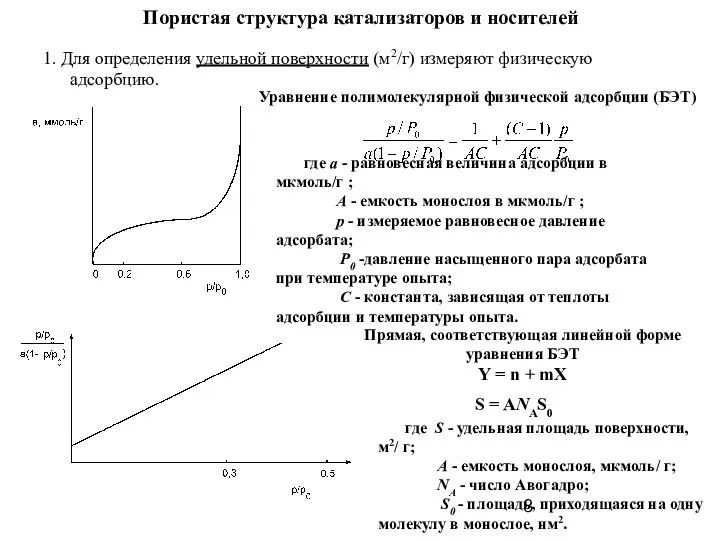
- 8. Пористая структура катализаторов и носителей 1. Для определения удельной поверхности (м2/г) измеряют физическую адсорбцию. Уравнение полимолекулярной
- 9. 2. Удельный объем пор катализатора : Vуд. = 3. Распределение пор по радиусам (эффективный радиус пор,
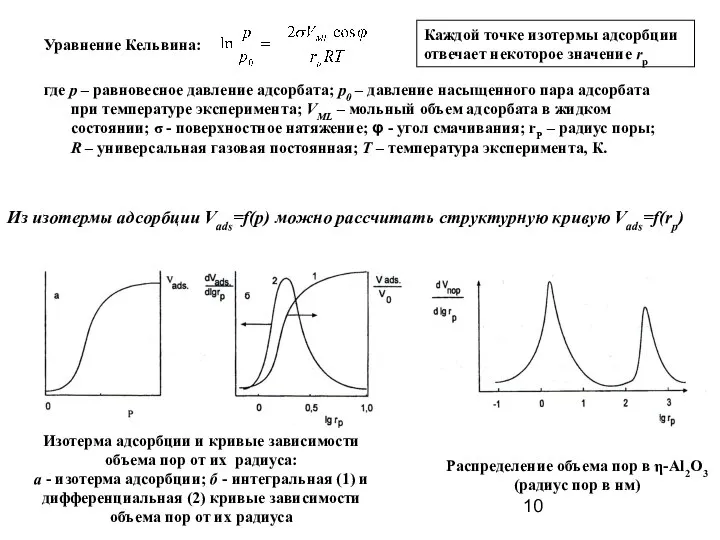
- 10. Уравнение Кельвина: где р – равновесное давление адсорбата; р0 – давление насыщенного пара адсорбата при температуре
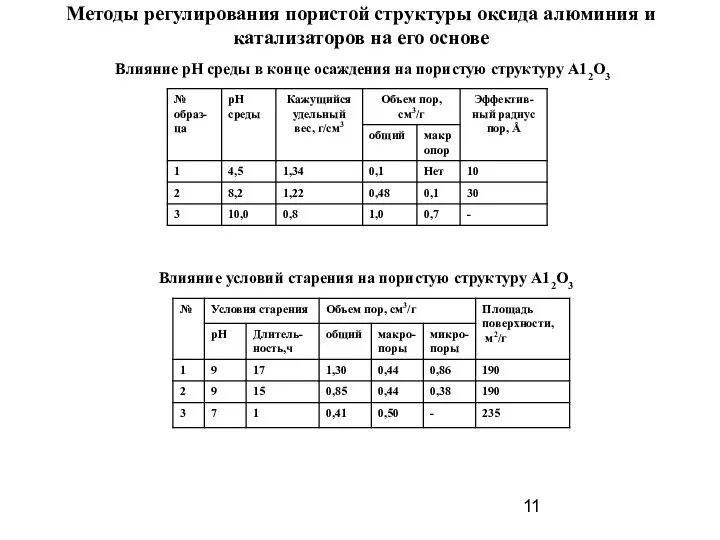
- 11. Методы регулирования пористой структуры оксида алюминия и катализаторов на его основе Влияние рН среды в конце
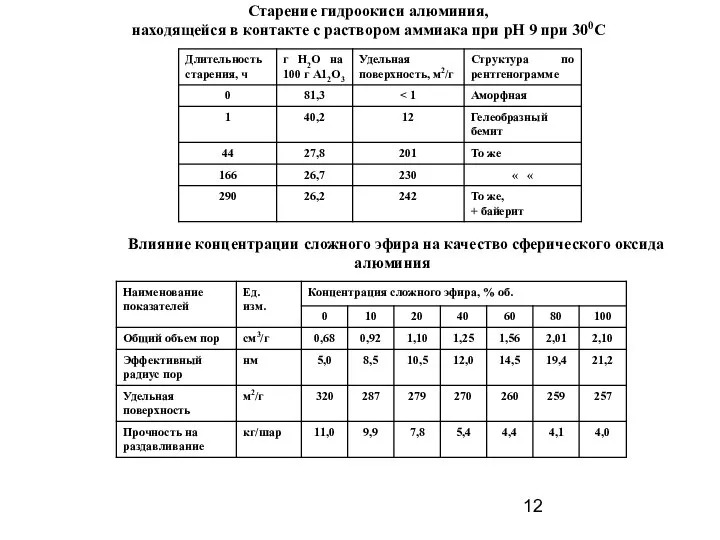
- 12. Старение гидроокиси алюминия, находящейся в контакте с раствором аммиака при рН 9 при 300С Влияние концентрации
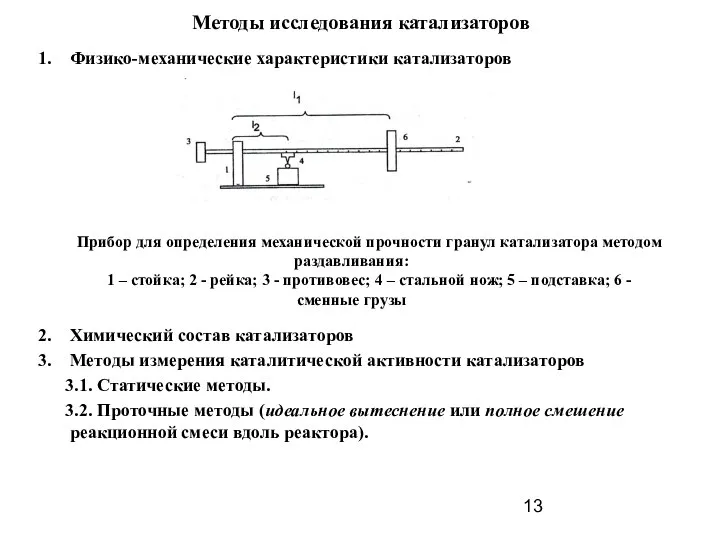
- 13. Методы исследования катализаторов Физико-механические характеристики катализаторов Химический состав катализаторов Методы измерения каталитической активности катализаторов 3.1. Статические
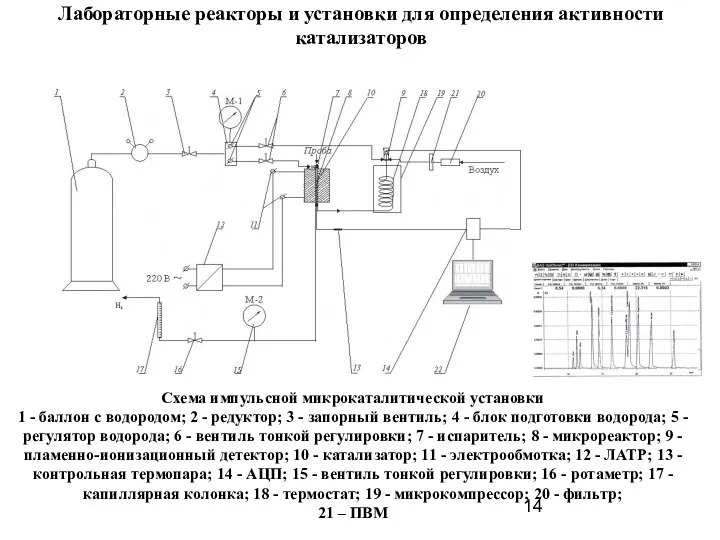
- 14. Лабораторные реакторы и установки для определения активности катализаторов Схема импульсной микрокаталитической установки 1 - баллон с
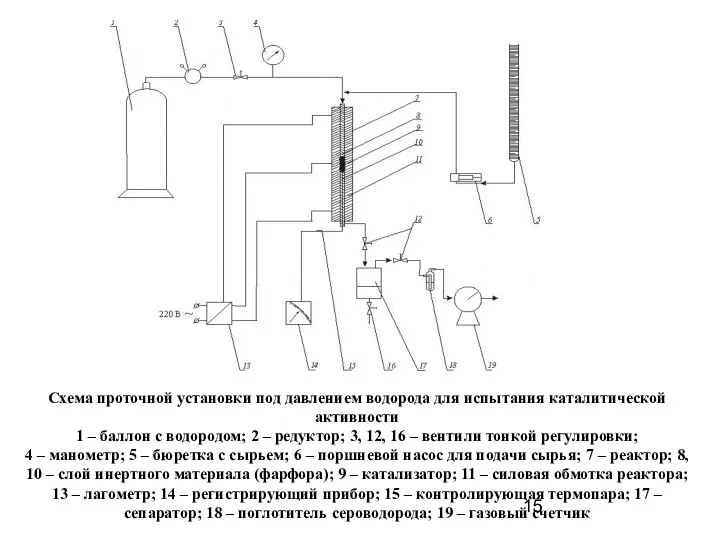
- 15. Схема проточной установки под давлением водорода для испытания каталитической активности 1 – баллон с водородом; 2
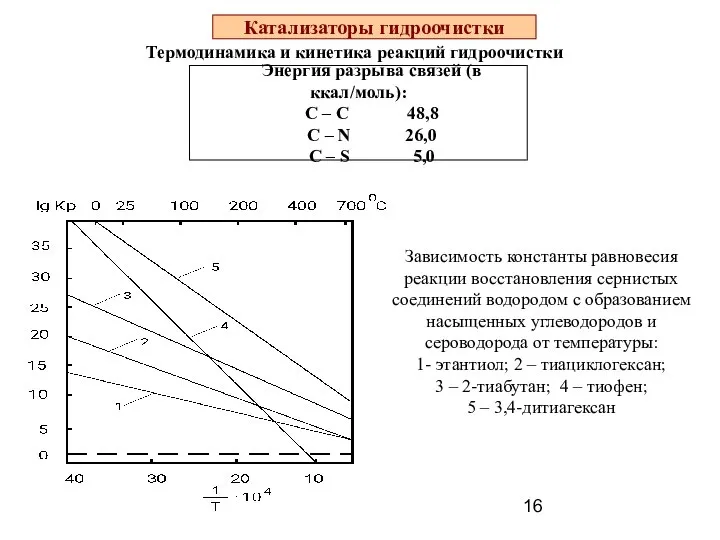
- 16. Катализаторы гидроочистки Термодинамика и кинетика реакций гидроочистки Энергия разрыва связей (в ккал/моль): С – С 48,8
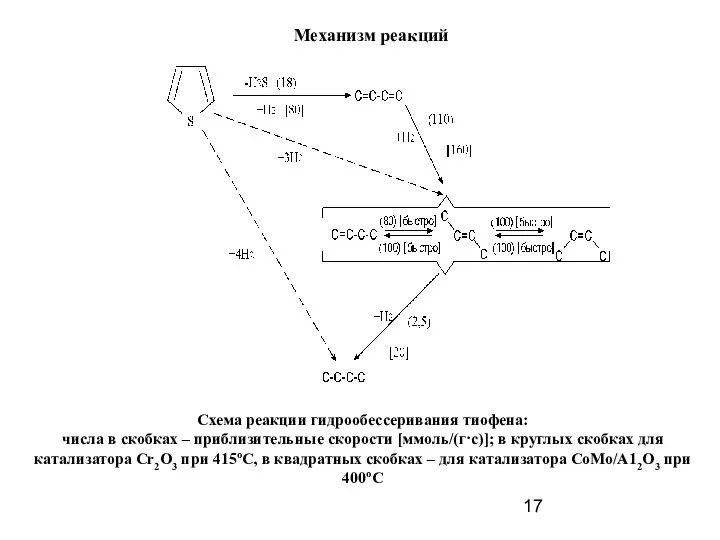
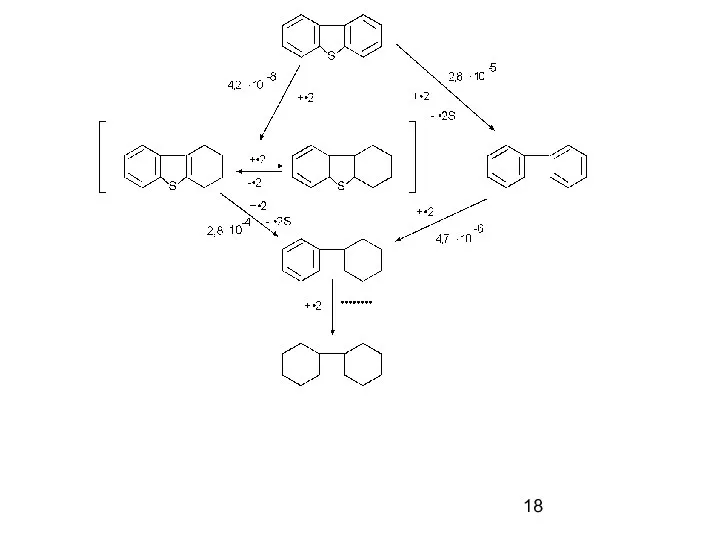
- 17. Механизм реакций Схема реакции гидрообессеривания тиофена: числа в скобках – приблизительные скорости [ммоль/(г·с)]; в круглых скобках
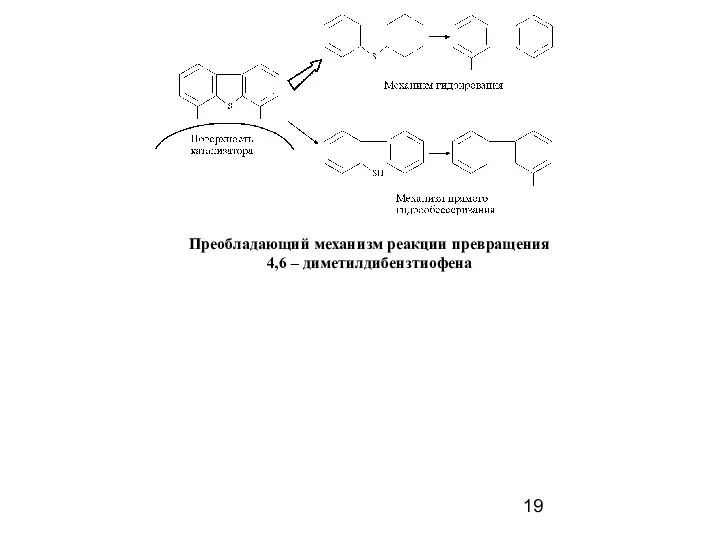
- 19. Преобладающий механизм реакции превращения 4,6 – диметилдибензтиофена
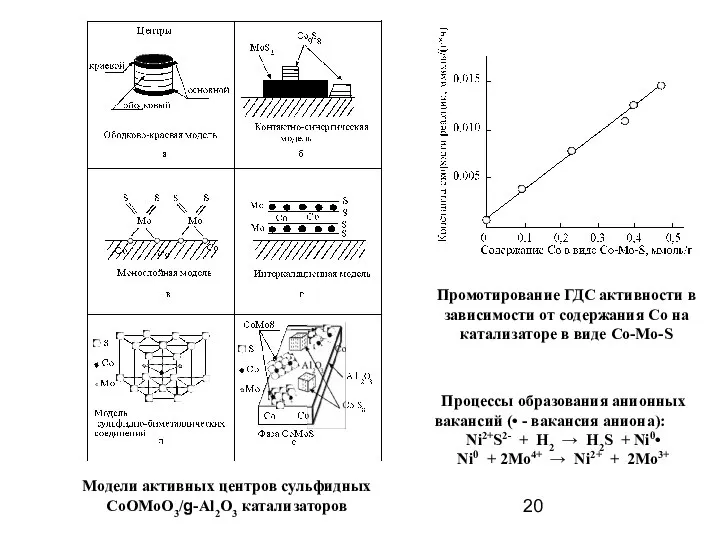
- 20. Модели активных центров сульфидных CoOMoO3/g-Al2O3 катализаторов Промотирование ГДС активности в зависимости от содержания Со на катализаторе
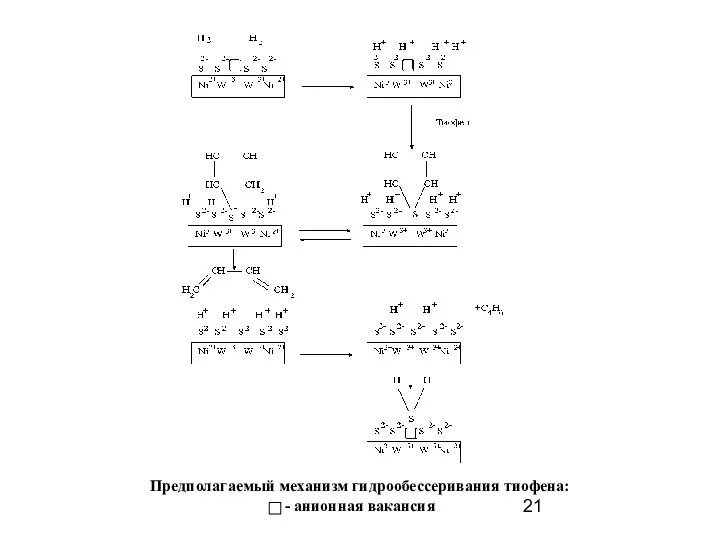
- 21. Предполагаемый механизм гидрообессеривания тиофена: - анионная вакансия
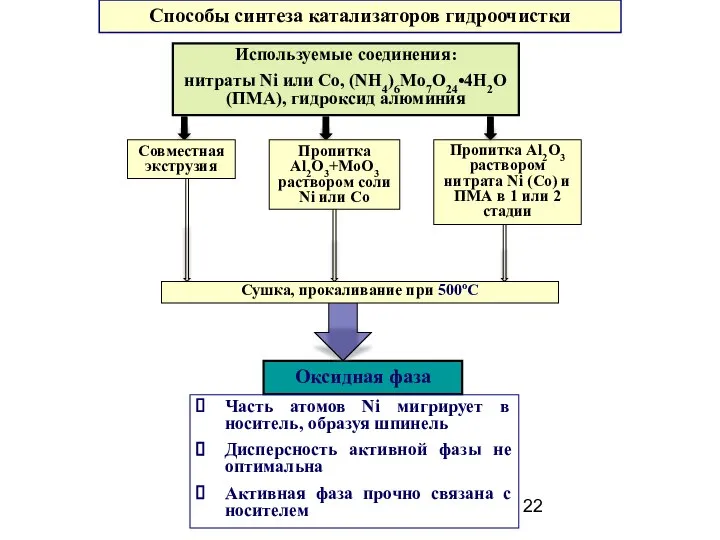
- 22. Способы синтеза катализаторов гидроочистки Оксидная фаза Часть атомов Ni мигрирует в носитель, образуя шпинель Дисперсность активной
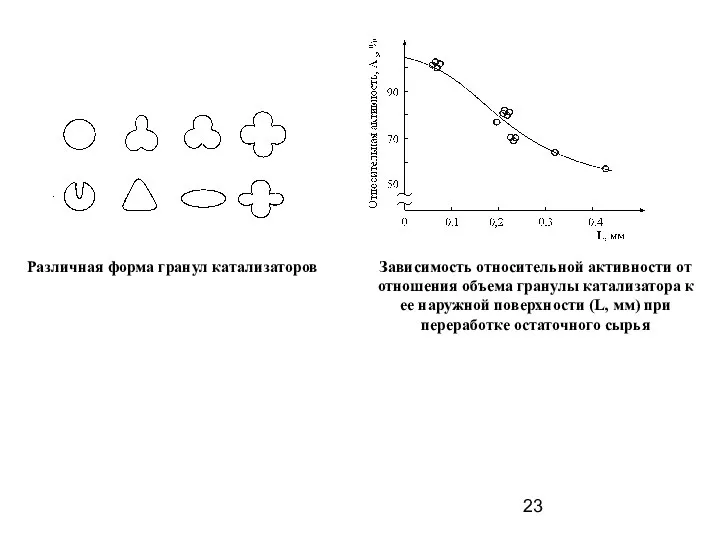
- 23. Различная форма гранул катализаторов Зависимость относительной активности от отношения объема гранулы катализатора к ее наружной поверхности
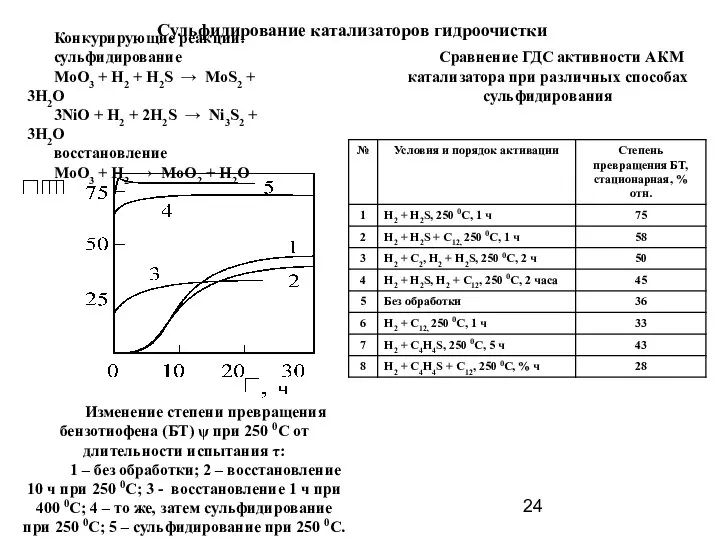
- 24. Сульфидирование катализаторов гидроочистки Конкурирующие реакции: сульфидирование MoO3 + H2 + H2S → MoS2 + 3H2O 3NiO
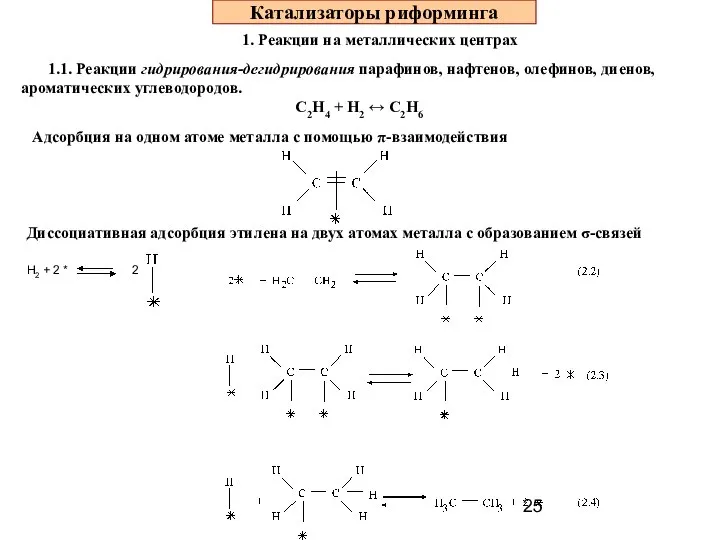
- 25. Катализаторы риформинга 1. Реакции на металлических центрах 1.1. Реакции гидрирования-дегидрирования парафинов, нафтенов, олефинов, диенов, ароматических углеводородов.
- 27. Скачать презентацию






 Современные и новейшие материалы
Современные и новейшие материалы Презентация по химии Типы изомерии 1.Историческая справка 2.Изомерия. Изомеры. 3.Типы изомерии. Классификация изомеров.
Презентация по химии Типы изомерии 1.Историческая справка 2.Изомерия. Изомеры. 3.Типы изомерии. Классификация изомеров.  Периодическая система химических элементов Д.И.Менделеева и строение атомов. (8 класс) (
Периодическая система химических элементов Д.И.Менделеева и строение атомов. (8 класс) ( Природные источники углеводородов
Природные источники углеводородов Соединения химических элементов
Соединения химических элементов Будівельні матеріали: скло, цемент, бетон та їх використання. Колообіг Оксигену,Нітрогену,Карбону в природі. Підготувала учен
Будівельні матеріали: скло, цемент, бетон та їх використання. Колообіг Оксигену,Нітрогену,Карбону в природі. Підготувала учен Зеленая химия и проблемы устойчивого развития
Зеленая химия и проблемы устойчивого развития Биологиялық мембрана
Биологиялық мембрана Презентация Галерея русских химиков
Презентация Галерея русских химиков  Адгезия және сулану. Дәріс 6
Адгезия және сулану. Дәріс 6 Физико-химические основы совместимости материалов и процессы коррозии
Физико-химические основы совместимости материалов и процессы коррозии Тема 4- фенолы
Тема 4- фенолы Изотопы, их свойства и применение
Изотопы, их свойства и применение Биологическое окисление
Биологическое окисление Степень окисления ОВР
Степень окисления ОВР Хлор 11 класс - Презентация
Хлор 11 класс - Презентация Експертиза коштовного каміння
Експертиза коштовного каміння Закономерности биохимии, токсикологии, изолирования и анализа «металлических» ядов. Первая помощь при отравлении
Закономерности биохимии, токсикологии, изолирования и анализа «металлических» ядов. Первая помощь при отравлении Электрохимические анализаторы медицинского назначения
Электрохимические анализаторы медицинского назначения Жиры. Сложные эфиры трехатомного
Жиры. Сложные эфиры трехатомного Химия в быту
Химия в быту Органічні речовини в живій природі
Органічні речовини в живій природі  Высокомолекулярные соединения. Общий курс
Высокомолекулярные соединения. Общий курс Р-элементы VI A группы. Свойства их соединений
Р-элементы VI A группы. Свойства их соединений Сера
Сера Отчет по элективному курсу по химии Тема: «Окислительные свойства концентрированной серной и азотной кислот». Выполнила ученица
Отчет по элективному курсу по химии Тема: «Окислительные свойства концентрированной серной и азотной кислот». Выполнила ученица  Закономерности в таблице Д. И. Менделеева
Закономерности в таблице Д. И. Менделеева Синергизм и синергические системы
Синергизм и синергические системы