Содержание
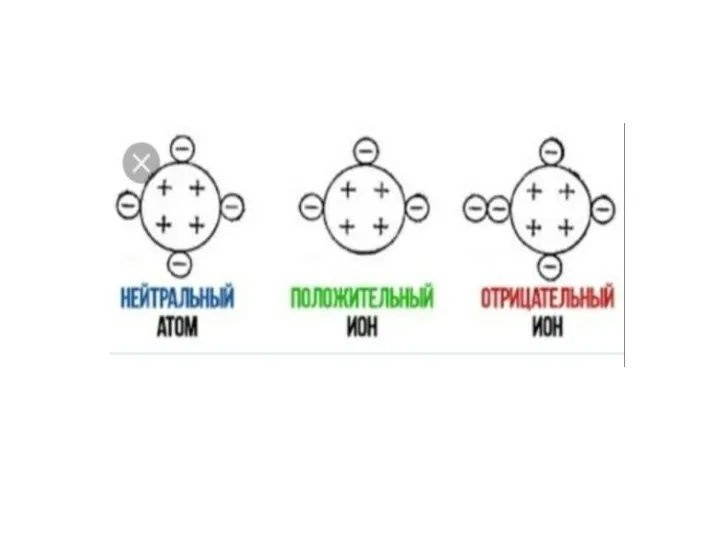
- 2. Повторение изученного ранее Что такое атом? Что такое ион? Чем отличается ион от атома? Какие типы
- 4. Степень окисления – это условный заряд атома в соединении , рассчитанный исходя из условия, что все
- 5. Правила вычисления степени окисления (СО) элементов:
- 6. Определите степени окисления атомов химических элементов по формулам их соединений: H2S, O2, NH3, HNO3, Fe, K2Cr2O7
- 7. +1 -2 0 -3 +1 +1 +5 -2 H2S O2 NH3 HNO3 0 +1 +6 -2
- 8. Расставьте степени окисления элементов в реакциях. Сравните, как ведут себя степени окисления в процессе реакции. HCl
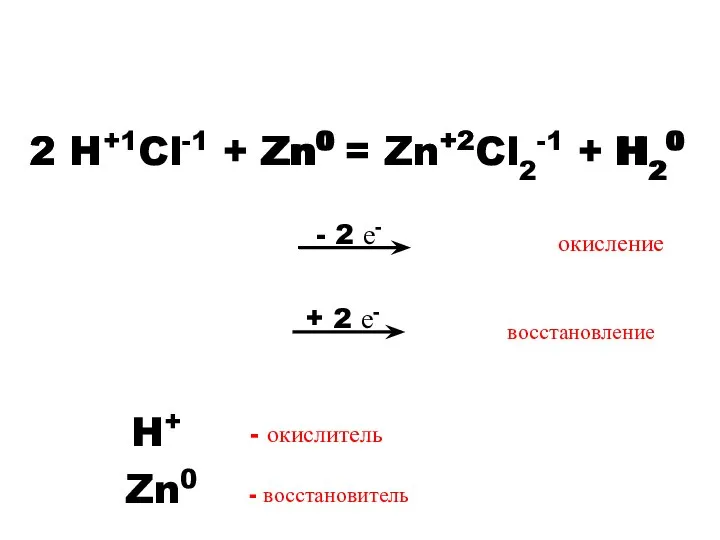
- 9. - 2 е- 2 H+1Cl-1 + Zn0 = Zn+2Cl2-1 + H20 Zn0 2 H+ Zn+2 H20
- 10. Окисление – процесс отдачи электронов. Восстановление – процесс присоединения электронов. Окислитель – элемент, принимающий электроны. Восстановитель
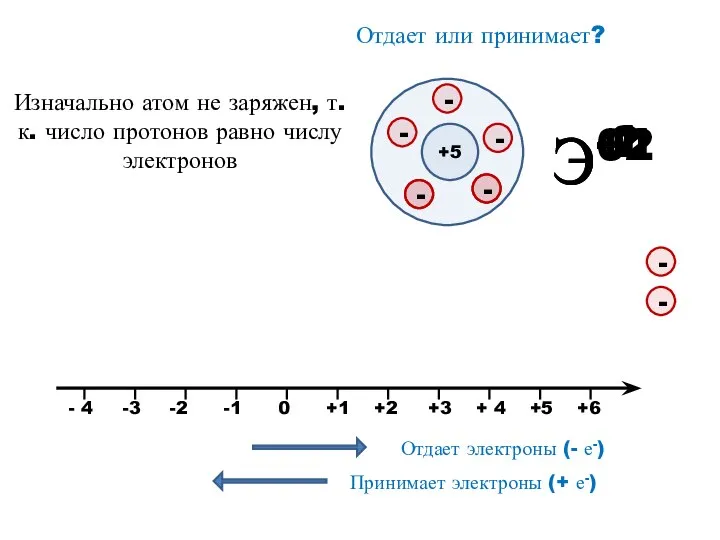
- 11. Э+1 Э+2 Э-2 Э-1 Отдает или принимает? +5 Изначально атом не заряжен, т.к. число протонов равно
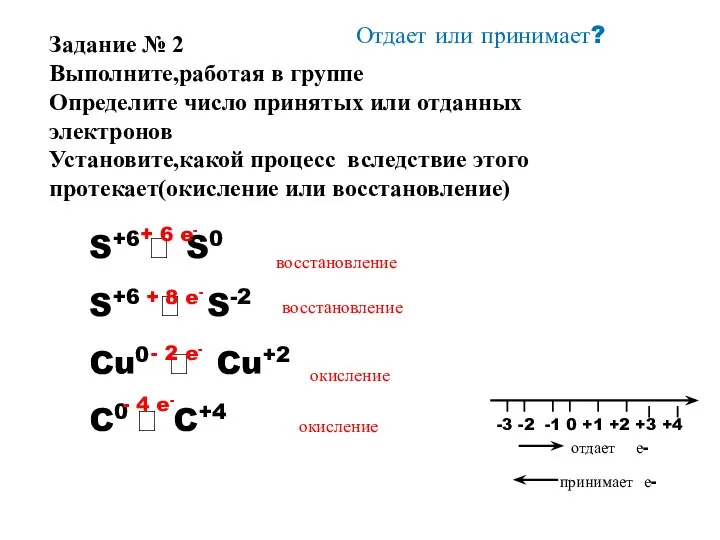
- 12. Отдает или принимает? S+6 ? S0 S+6 ? S-2 Cu0 ? Cu+2 C0 ? C+4 +
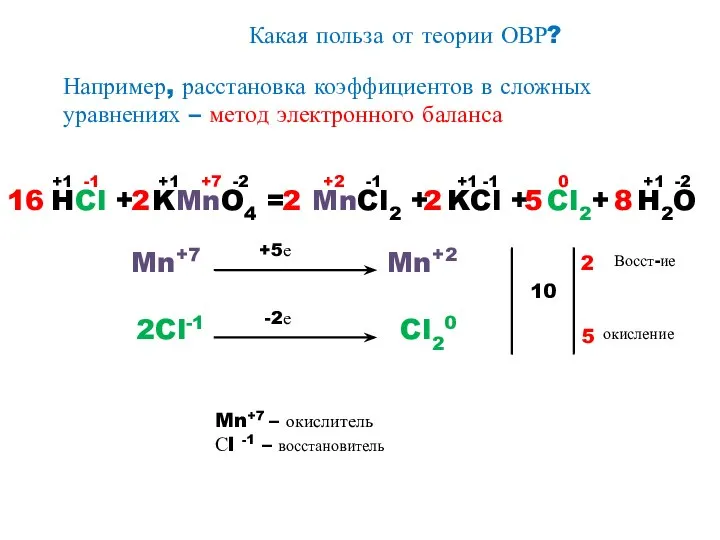
- 13. Какая польза от теории ОВР? Например, расстановка коэффициентов в сложных уравнениях – метод электронного баланса HCl
- 14. План составления уравнений ОВР и электронного баланса к ним 1. Записать схему реакции. 2. Определить, атомы
- 15. AgNO3 + Cu → Cu(NO3)2 + Ag↓ Ag+1 +1 e Ag0 Cu0 - 2 e Cu+2
- 16. ОВР в быту
- 17. Выяснить, как окислительно-восстановительные реакции применяются в быту. Цель работы:
- 18. Газ метан горит бесцветным пламенем с образованием воды и углекислого газа СН4+2О2=СО2+2Н2О Горение газа на кухне
- 19. При обработке персолью отбеливание происходит за счет окисления загрязнений 2H2O2=2H2O+O2. Для того чтобы образующийся кислород не
- 20. При взаимодействии железа и кислорода образуется ржавчина. 4Fe+ 2O2= 2Fe2O3 Коррозия металла
- 21. Мы часто сталкиваемся с окислительно-восстановительными реакциями в быту: при горении газа; при коррозии металлов; при отбеливании
- 22. Задание №3 Выполните, работая в группе 1. Из приведенных схем уравнений реакций выпишите те, которые можно
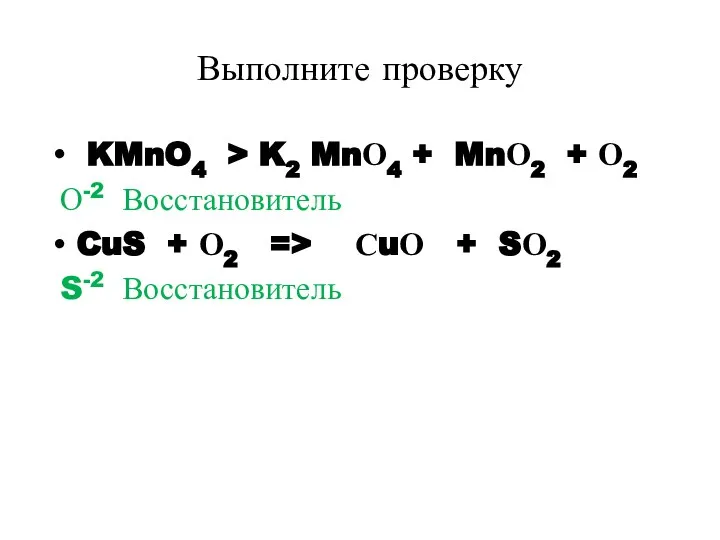
- 23. Выполните проверку KMnO4 > K2 MnО4 + MnО2 + О2 О-2 Восстановитель CuS + О2 =>
- 25. Скачать презентацию
















 Алюминий и его соединения
Алюминий и его соединения Использование QR-кода в обучении химии
Использование QR-кода в обучении химии Органические вяжущие. Битумы
Органические вяжущие. Битумы Гидролиз солей
Гидролиз солей Презентация по дисциплине «Химия» по теме: «Нефть, состав и свойства. Переработка нефти. Нефтепродукты, их применение.» студентк
Презентация по дисциплине «Химия» по теме: «Нефть, состав и свойства. Переработка нефти. Нефтепродукты, их применение.» студентк Молекулы. Свойства молекул
Молекулы. Свойства молекул Хімічні мутагени
Хімічні мутагени  Электролизные установки
Электролизные установки Строение ядра
Строение ядра Презентация Фосфор 9 класс
Презентация Фосфор 9 класс Оксиды
Оксиды  Растворы, классификация растворов
Растворы, классификация растворов Азот
Азот Нефть. Состав. Свойства. Переработка
Нефть. Состав. Свойства. Переработка Колообіг Карбону в природі Оленченко Катерина, 11-Б
Колообіг Карбону в природі Оленченко Катерина, 11-Б  Презентация по Химии "Апатит" - скачать смотреть
Презентация по Химии "Апатит" - скачать смотреть  Гідроліз солей
Гідроліз солей Регуляция трансляции. Посттрансляционные модификации белков. (Лекция 9)
Регуляция трансляции. Посттрансляционные модификации белков. (Лекция 9) Бериллий (Beryllium) Be
Бериллий (Beryllium) Be Презентация по химии Хлор
Презентация по химии Хлор алмаз
алмаз Бытовая химия в нашей жизни
Бытовая химия в нашей жизни ОВР в органической химии Автор: Тятин Павел Владимирович, 11М класс, МОУ лицей №6 Руководитель: Дробот Светлана Сергеевна , учит
ОВР в органической химии Автор: Тятин Павел Владимирович, 11М класс, МОУ лицей №6 Руководитель: Дробот Светлана Сергеевна , учит Бутан как хладагент
Бутан как хладагент “Физикалық химия” курсы бойынша жеке бағдарланған индивидуалды зерттеу жұмысы
“Физикалық химия” курсы бойынша жеке бағдарланған индивидуалды зерттеу жұмысы Разработка проектных решений по переводу паровых котлов электростанций в конденсационный режим с целью увеличения кпд котла
Разработка проектных решений по переводу паровых котлов электростанций в конденсационный режим с целью увеличения кпд котла Презентация по Химии "Гидролиз солей" - скачать смотреть бесплатно
Презентация по Химии "Гидролиз солей" - скачать смотреть бесплатно Растворы и процессы, проходящие в растворах. Протолитическая теория кислот и оснований
Растворы и процессы, проходящие в растворах. Протолитическая теория кислот и оснований