Содержание
- 2. Для характеристики состояния элементов в соединениях введено понятие степени окисления. Степень окисления (СО) - определяется как
- 3. – кислород O–2 (Исключение: – водород H: +1 (Исключение: гидриды ПРАВИЛО: В целом молекула электронейтральна. Сумма
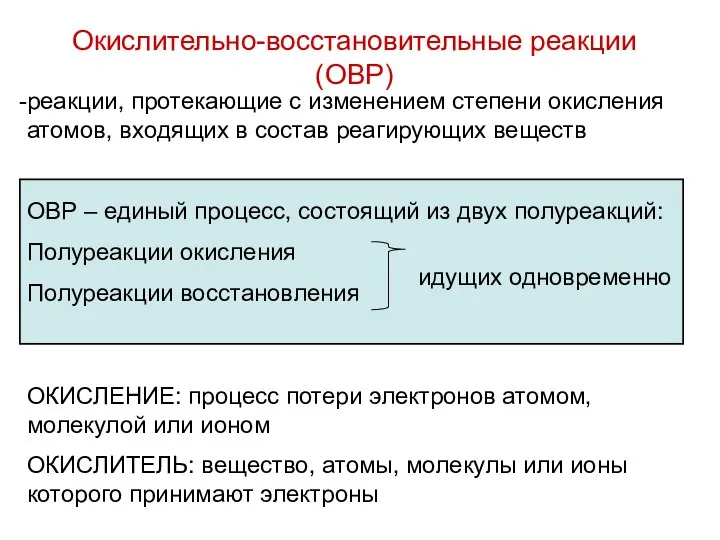
- 4. Окислительно-восстановительные реакции (ОВР) реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ ОВР
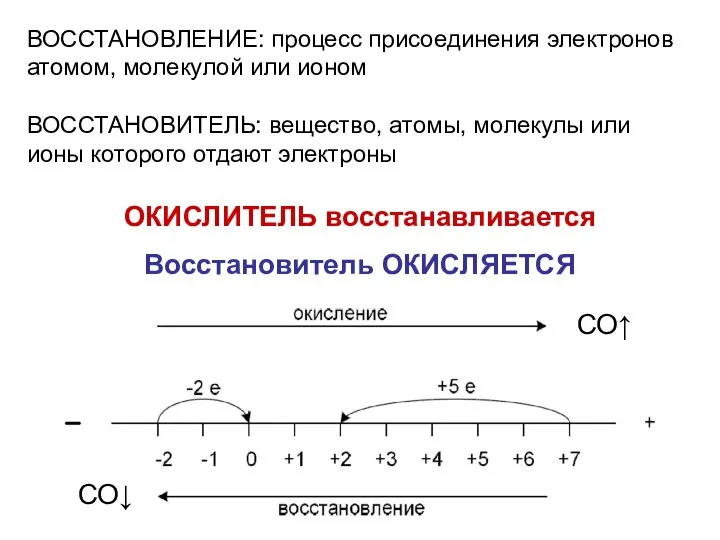
- 5. ВОССТАНОВЛЕНИЕ: процесс присоединения электронов атомом, молекулой или ионом ВОССТАНОВИТЕЛЬ: вещество, атомы, молекулы или ионы которого отдают
- 6. ТИПЫ ОВР 1. Межмолекулярные ОВР - реакции с изменением СО атомов в молекулах разных веществ 2.
- 7. 3. Реакции диспропорционирования – реакции с изменением СО одинаковых атомов в молекуле одного вещества 4. Реакции
- 8. ТИПИЧНЫЕ ОКИСЛИТЕЛИ Простые вещества, образуемые атомами VIА и VIIА групп с высокой электроотрицательностью (О2, Сl2, Br2).
- 9. Вещество в промежуточной степени окисления может вести себя и как окислитель: и как восстановитель:
- 10. ПРОТЕКАНИЕ ОВР ЗАВИСИТ ОТ рН СРЕДЫ 1. Кислотная среда Фиол. б/ц. 2. Нейтральная среда Фиол. бурый
- 11. Уравнивание ОВР основано на том, что число отданных и принятых ē должно быть одинаковым. Порядок уравнивания
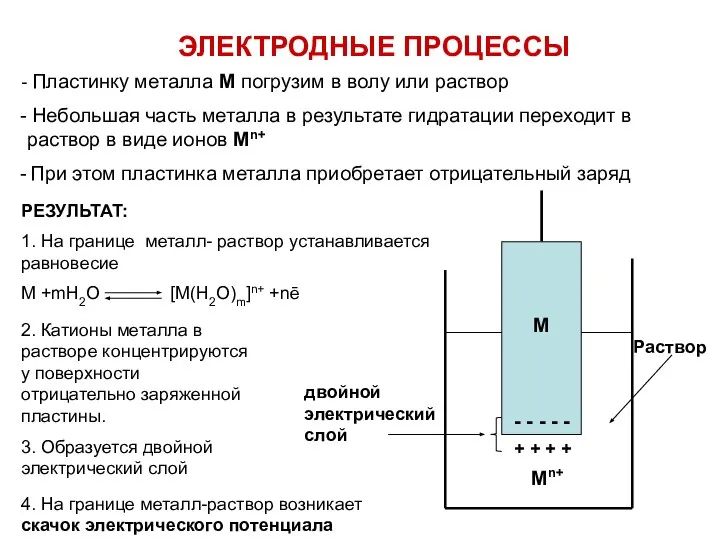
- 12. ЭЛЕКТРОДНЫЕ ПРОЦЕССЫ Пластинку металла М погрузим в волу или раствор Небольшая часть металла в результате гидратации
- 13. Скачок потенциала на границе металл-раствор электролита называют ЭЛЕКТРОДНЫМ ПОТЕНЦИАЛОМ - Е [В] Величина электродного потенциала зависит
- 14. СТАНДАРТНЫЙ ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ (Е0) – потенциал данного электродного процесса при концентрациях каждого из участвующих веществ 1
- 15. Направление ОВР Количественной характеристикой окислительно-восстановительных процессов являются нормальные окислительно-восстановительные потенциалы окислителей и восстановителей или стандартные потен-
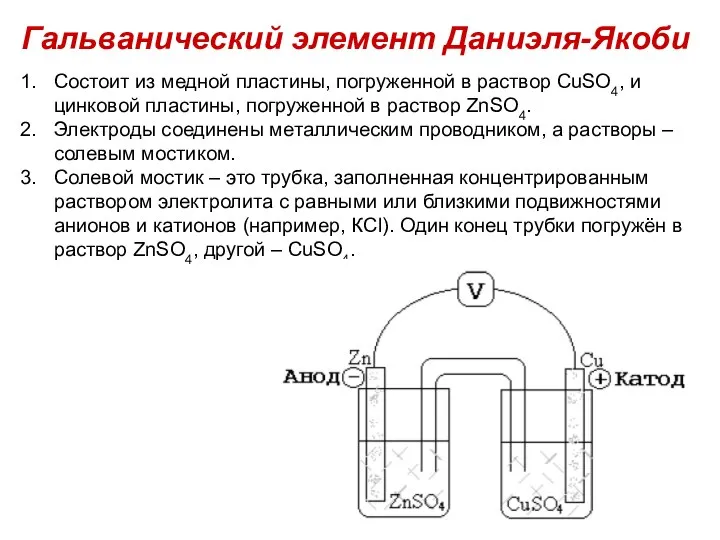
- 18. Состоит из медной пластины, погруженной в раствор CuSО4, и цинковой пластины, погруженной в раствор ZnSО4. Электроды
- 19. При погружении металлического проводника в раствор, содержащий катионы того же самого металла, устанавливается динамическое равновесие между
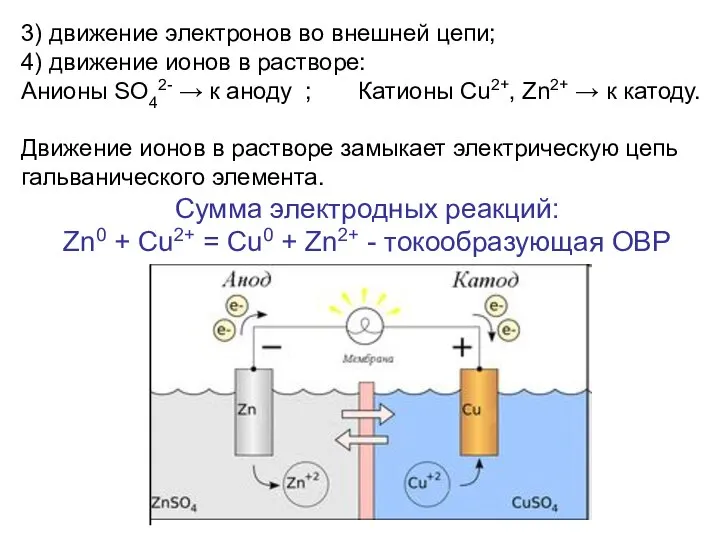
- 20. При работе элемента Даниэля – Якоби протекают следующие процессы: реакция окисления цинка Zn0 – 2ē →
- 21. 3) движение электронов во внешней цепи; 4) движение ионов в растворе: Анионы SO42- → к аноду
- 22. ТАКИМ ОБРАЗОМ: если ОВР в электрохимической цепи протекает самопроизвольно, то такая цепь называется гальваническим элементом. Гальванические
- 24. Скачать презентацию
















 Нафтопереробна промисловість України
Нафтопереробна промисловість України  Галогены в организме человека
Галогены в организме человека Нітроген
Нітроген  Цинк. Месторождения. Применение
Цинк. Месторождения. Применение Реакции горения и материальный баланс котла
Реакции горения и материальный баланс котла Отчет по производственной практике. Место производственной практики ФГБОУ ВО «Пермской ГСХА», кафедра агрохимии
Отчет по производственной практике. Место производственной практики ФГБОУ ВО «Пермской ГСХА», кафедра агрохимии Окисно-відновні процеси
Окисно-відновні процеси Тепловая обработка металлов. Особенности роста кристаллов при фазовых превращениях в твердом состоянии
Тепловая обработка металлов. Особенности роста кристаллов при фазовых превращениях в твердом состоянии Коррозия металлов
Коррозия металлов II группа периодической системы Д. И. Менделеева. Магния сульфат. Кальция хлорид
II группа периодической системы Д. И. Менделеева. Магния сульфат. Кальция хлорид Динамическая вулканизация термоэластопластов
Динамическая вулканизация термоэластопластов Презентация по Химии "«Нитраты и организм человека»" - скачать смотреть
Презентация по Химии "«Нитраты и организм человека»" - скачать смотреть  Периодический закон и периодическая система Д.И.Менделеева. Лекция 4
Периодический закон и периодическая система Д.И.Менделеева. Лекция 4 Минералдарды зерттеу әдістері
Минералдарды зерттеу әдістері «АТОМНАЯ ЭНЕРГЕТИКА»
«АТОМНАЯ ЭНЕРГЕТИКА»  Пластмасса в жизни людей. Изготовление пластмассы в домашних условиях
Пластмасса в жизни людей. Изготовление пластмассы в домашних условиях Физические и химические свойства воды
Физические и химические свойства воды Виконали учениці 33-ї групи Виконали учениці 33-ї групи Українського гуманітарного ліцею КНУ імені Тараса Шевченка Клименко
Виконали учениці 33-ї групи Виконали учениці 33-ї групи Українського гуманітарного ліцею КНУ імені Тараса Шевченка Клименко Видатні вітчизняні хіміки
Видатні вітчизняні хіміки Кремнийдің құрамы, құрылысы және қасиеттері
Кремнийдің құрамы, құрылысы және қасиеттері Полифункциональные соединения. Гетерофункциональные соединения. Структура и функции биолекул
Полифункциональные соединения. Гетерофункциональные соединения. Структура и функции биолекул Углеводы (моносахариды, олигосахариды, полисахариды)
Углеводы (моносахариды, олигосахариды, полисахариды) Галогенопроизводные углеводородов. (Лекция 8)
Галогенопроизводные углеводородов. (Лекция 8) Лаборатория мирового уровня в области термического анализа и физико-химии процессов тепловых методов добычи
Лаборатория мирового уровня в области термического анализа и физико-химии процессов тепловых методов добычи Физико-химия поверхностных явлений
Физико-химия поверхностных явлений Периодическая система химических элементов Д.И.Менделеева и строение атомов. (8 класс) (
Периодическая система химических элементов Д.И.Менделеева и строение атомов. (8 класс) ( Структура ЕГЭ по химии. Электролиз
Структура ЕГЭ по химии. Электролиз Органическая химия. Химические свойства и типы реакций. (9 класс)
Органическая химия. Химические свойства и типы реакций. (9 класс)