Содержание
- 2. Теория окислительно-восстановительных реакций: Реакции, протекающее с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются
- 3. Основные положения теории: называется процесс отдачи электронов атомов, молекулой или ионом: называется процесс присоединения электронов атомом,
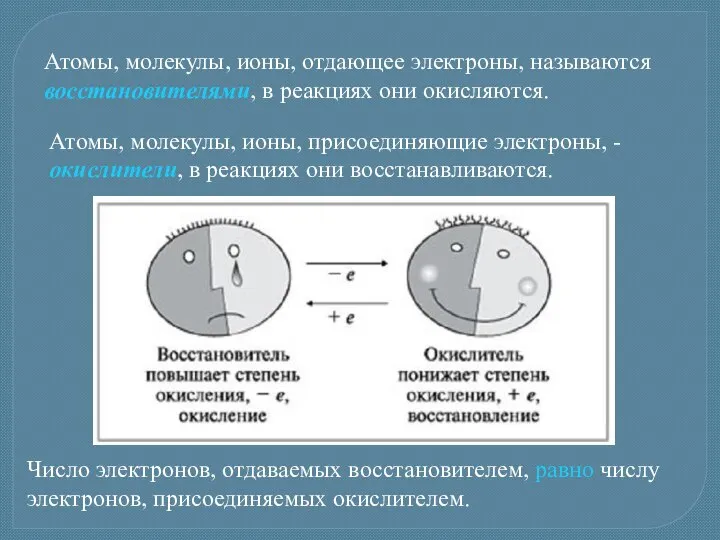
- 4. Атомы, молекулы, ионы, отдающее электроны, называются восстановителями, в реакциях они окисляются. Атомы, молекулы, ионы, присоединяющие электроны,
- 5. Важнейшие восстановители и окислители
- 6. Из истории происхождения окислительно-восстановительных реакций: Издавна ученые полагали, что окисление — это потеря флогистона (особого невидимого
- 7. Составление уравнений окислительно-восстановительных реакций Метод электронного баланса (тв.+тв., тв.+газ) Ионно-электронный метод (в растворах)
- 8. Метод электронного баланса +1 +7 –2 +1 –1 +1 –1 +2 –1 0 +1 –2 KMnO4
- 9. Классификация окислительно-восстановительных реакций Межмолекулярные Внутримолекулярные 2Al+Fe2O3=2Fe+Al2O3 2KClO3=2KCl+3O2 Атомы разных элементов, изменяющие степени окисления, находятся в одной
- 10. МЕЖМОЛЕКУЛЯРНЫЕ +1 +5 –2 0 +1 –1 +5 –2 5 KClO3 + 6P = 5KCl +
- 11. Классификация окислительно-восстановительных реакций РЕАКЦИИ ДИСПРОПОРЦИОНИРОВАНИЯ РЕАКЦИИ КОНПРОПОРЦИОНИРОВАНИЯ 4K2SO3=3K2SO4+K2S Процессы, в результате которых происходит изменение степени окисления
- 12. Диспропорционирование(дисмутация, самоокисление-самовосстановление) +1 +5 –2 Δ +1 –1 +1 +7 –2 4KClO3 = KCl + 3KClO4
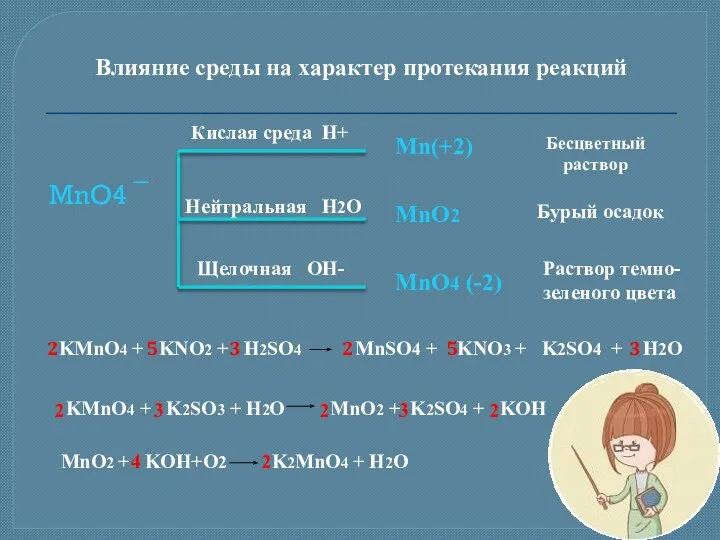
- 13. Влияние среды на характер протекания реакций MnO4 ¯ Кислая среда H+ Нейтральная H2O Щелочная OH- Mn(+2)
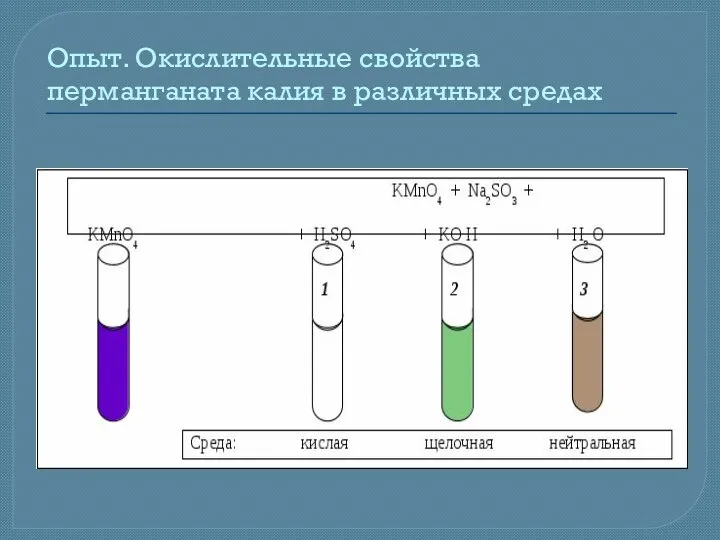
- 14. Опыт. Окислительные свойства перманганата калия в различных средах
- 15. Окислительные свойства перманганата калия в различных средах Расставить коэффициенты в молекулярном уравнении реакции: а) в кислой
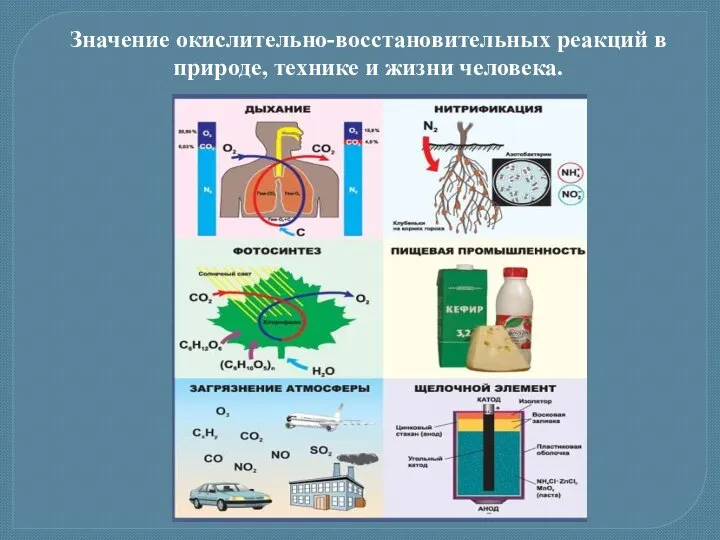
- 16. Значение окислительно-восстановительных реакций в природе, технике и жизни человека.
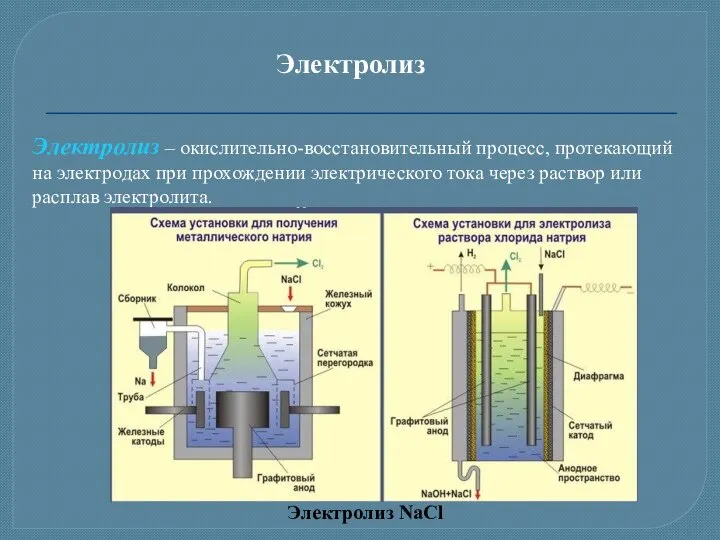
- 17. Электролиз Электролиз – окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через раствор или расплав
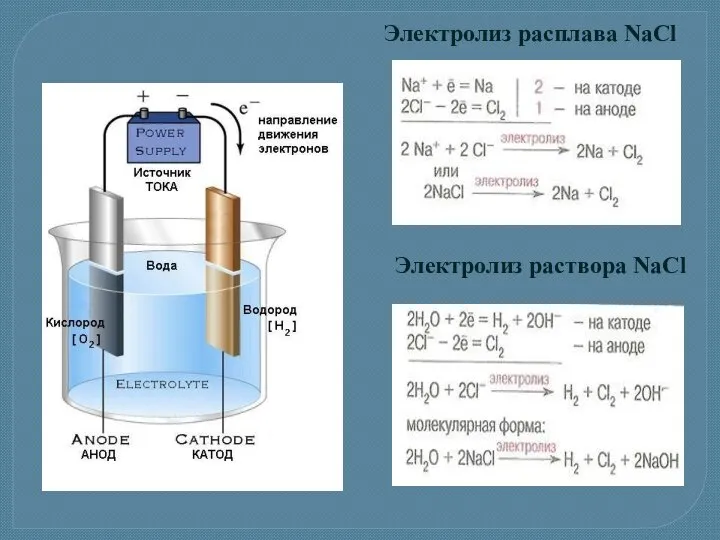
- 18. Электролиз расплава NaCl Электролиз раствора NaCl
- 20. Скачать презентацию











 Липиды. Химические свойства
Липиды. Химические свойства Соли
Соли Углерод и его соединения
Углерод и его соединения гетероциклич
гетероциклич Стирол - важнейшее производное бензола
Стирол - важнейшее производное бензола Кумарины
Кумарины АЛЬДЕГИДЫ - органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом во
АЛЬДЕГИДЫ - органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом во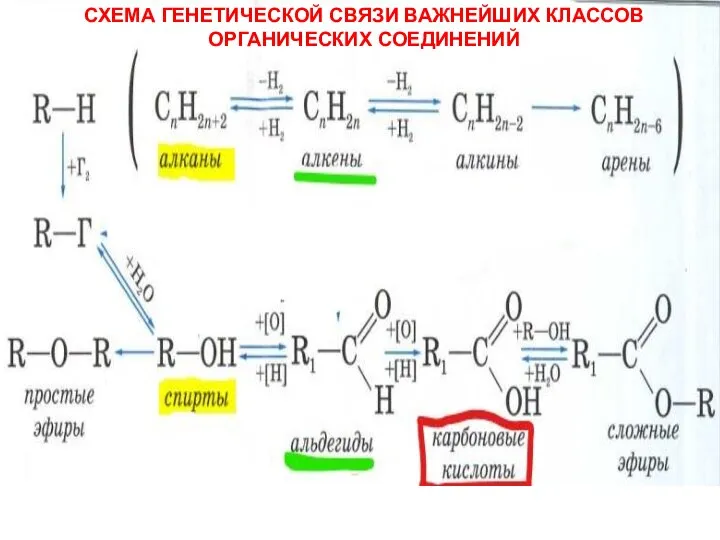 Схема генетической связи важнейших классов органических соединений
Схема генетической связи важнейших классов органических соединений Химическая связь в комплексных соединениях
Химическая связь в комплексных соединениях Основные физико-химические процессы очистки воды. Опыт исследования коагулянтов и флокулянтов
Основные физико-химические процессы очистки воды. Опыт исследования коагулянтов и флокулянтов Химические свойства основных классов неорганических соединений
Химические свойства основных классов неорганических соединений Белоктар – биополимерлер
Белоктар – биополимерлер Тугоплавкие металлы и их сплавы
Тугоплавкие металлы и их сплавы Роль металлов в истории человеческой цивилизации
Роль металлов в истории человеческой цивилизации Классификация веществ по характеру связи
Классификация веществ по характеру связи Высокоэффективная жидкостная хроматография
Высокоэффективная жидкостная хроматография Комплексные соединения
Комплексные соединения Уксусная кислота
Уксусная кислота Химическая кинетика
Химическая кинетика Газообразные вещества. Парниковый эффект
Газообразные вещества. Парниковый эффект Атомный уровень. Химия простых веществ. Молекулярный уровень. Химия соединений. Живое субклеточный уровень
Атомный уровень. Химия простых веществ. Молекулярный уровень. Химия соединений. Живое субклеточный уровень Поделочный камень родонит
Поделочный камень родонит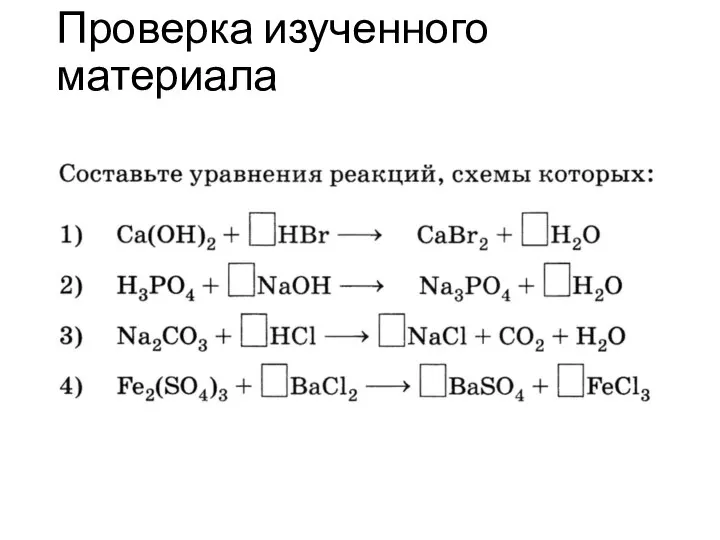 Реакции замещения
Реакции замещения Пиролиз нефтяного сырья
Пиролиз нефтяного сырья Геохимия и космохимия: история возникновения и развития, основное содержание и задачи
Геохимия и космохимия: история возникновения и развития, основное содержание и задачи Предмет биоорганической химии. Классификация, строение, реакционная способность органических соединений
Предмет биоорганической химии. Классификация, строение, реакционная способность органических соединений Зеленая химия и проблемы устойчивого развития
Зеленая химия и проблемы устойчивого развития Основы химической термодинамики
Основы химической термодинамики