Содержание
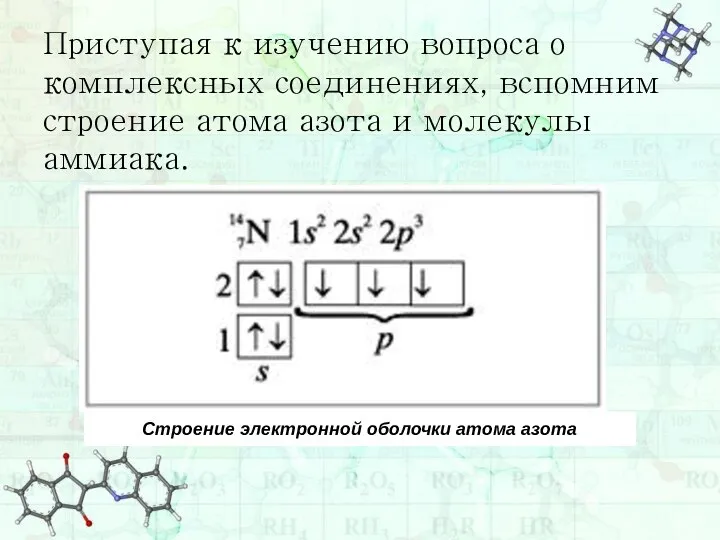
- 2. Приступая к изучению вопроса о комплексных соединениях, вспомним строение атома азота и молекулы аммиака.
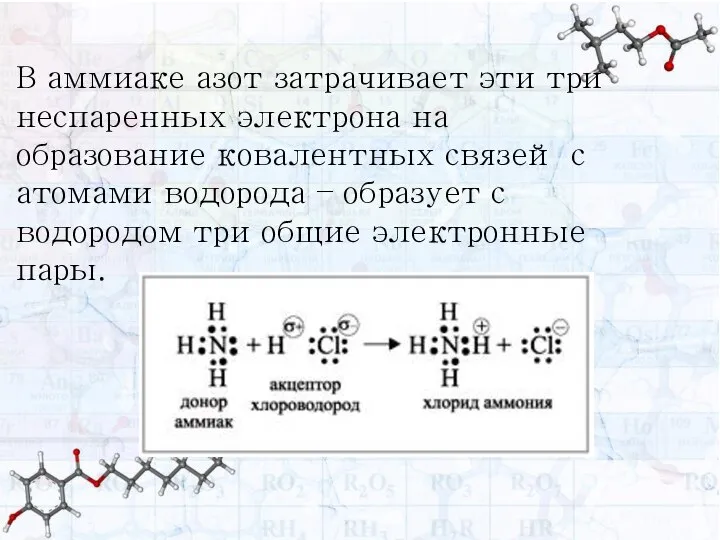
- 3. В аммиаке азот затрачивает эти три неспаренных электрона на образование ковалентных связей с атомами водорода –
- 4. Соединения, образование которых не связано с возникновением новых электронных пар (общая электронная пара образовалась за счет
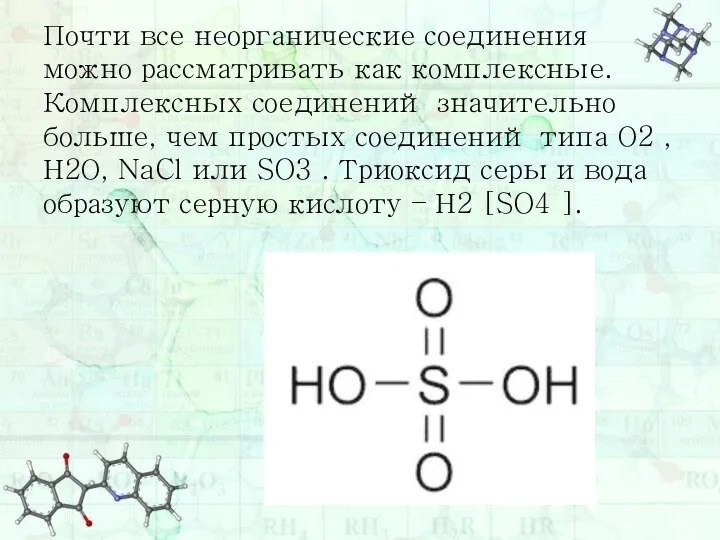
- 5. Почти все неорганические соединения можно рассматривать как комплексные. Комплексных соединений значительно больше, чем простых соединений типа
- 6. Наиболее удачно строение и своиства таких соединений объясняет координационная теория. Создатель теории – шведский ученый Альфред
- 7. Виды комплексных соединений Комплексные соединения Соли Пример: K3[Fe(CN)6] Основания Пример: [Ag(NH3)2]OH Кислоты Пример: H[AuCl4]
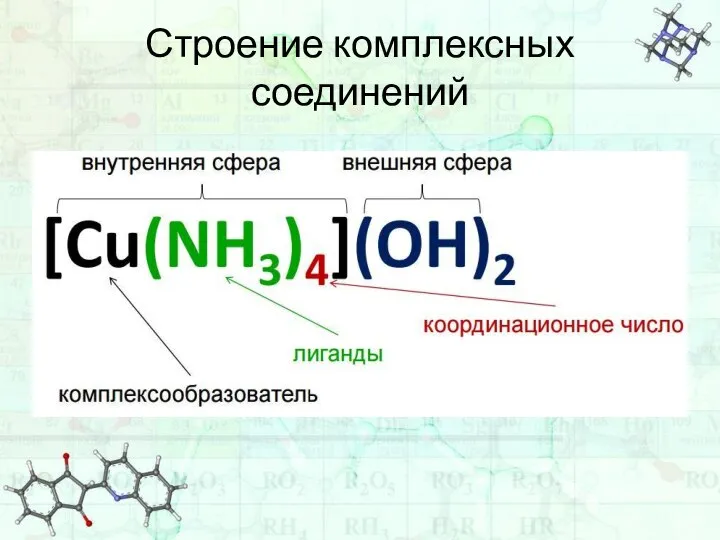
- 8. Строение комплексных соединений
- 9. 1. Установить, входит ли в него комплексный катион или комплексный анион. Название соединения, содержащего комплексный катион,
- 10. 2.Если этих лигандов больше чем один, то их названию предшествует соответствующее греческое числительное: 2 – ди,
- 11. 3.После названия лигандов — ионов название лигандов — нейтральных молекул. При этом NH3 называют аммин, NO
- 12. 4. Затем следует название центрального иона комплексообразователя, которое производят от латинского названия элемента с различными окончаниями
- 13. 5. В комплексных анионах добавляется суффикс «ат» к названию комплексообразователя Пример: Na[Ag(CN)2] дицианоаргентаАТ натрия
- 14. Составьте комплексные соединения, обозначьте составные части. Na[Al(OH)4 ] – Na[Al(OH)6 ] – Na[Al(OH)4 (H2O)2 ] –
- 15. Демонстрационный опыт Cu(OH)2 + 4NH3 = [Cu(NH3 )4 ](OH)2
- 16. K3 [Fe(CN)6 ] – красная кровяная соль
- 17. К3[Fe(CN)6 ] +3 Fe SO4 = KFe[Fe(CN)6])↓ + 3K2SO4
- 18. K4 [Fe(CN)6 ] – желтая кровяная соль
- 19. 4FeCl3+3K4[Fe(CN)6]=Fe4[Fe(CN)6]3+12KCl
- 20. [Ag(NH3 )2 ]OH – аммиачныйраствор оксида серебра
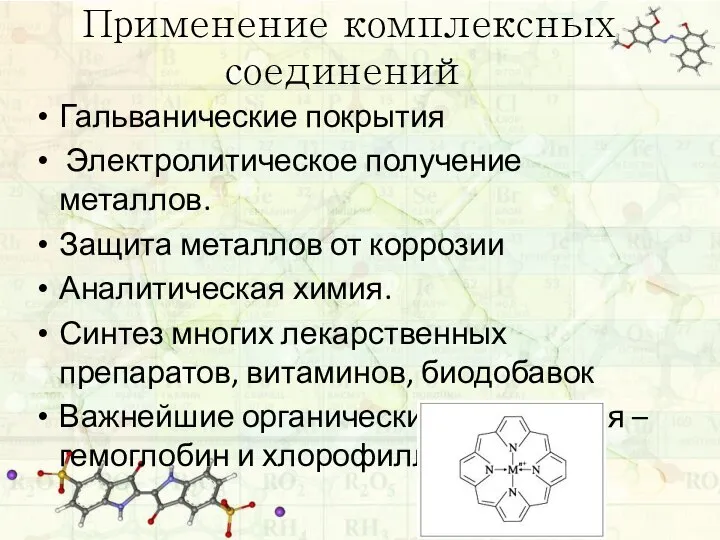
- 21. Применение комплексных соединений Гальванические покрытия Электролитическое получение металлов. Защита металлов от коррозии Аналитическая химия. Синтез многих
- 23. Скачать презентацию


![Виды комплексных соединений Комплексные соединения Соли Пример: K3[Fe(CN)6] Основания Пример: [Ag(NH3)2]OH Кислоты Пример: H[AuCl4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1407007/slide-6.jpg)




![5. В комплексных анионах добавляется суффикс «ат» к названию комплексообразователя Пример: Na[Ag(CN)2] дицианоаргентаАТ натрия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1407007/slide-12.jpg)
![Составьте комплексные соединения, обозначьте составные части. Na[Al(OH)4 ] – Na[Al(OH)6 ]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1407007/slide-13.jpg)
2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1407007/slide-14.jpg)
![K3 [Fe(CN)6 ] – красная кровяная соль](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1407007/slide-15.jpg)
![К3[Fe(CN)6 ] +3 Fe SO4 = KFe[Fe(CN)6])↓ + 3K2SO4](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1407007/slide-16.jpg)
![K4 [Fe(CN)6 ] – желтая кровяная соль](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1407007/slide-17.jpg)
![4FeCl3+3K4[Fe(CN)6]=Fe4[Fe(CN)6]3+12KCl](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1407007/slide-18.jpg)
![[Ag(NH3 )2 ]OH – аммиачныйраствор оксида серебра](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1407007/slide-19.jpg)
 Термическая обработка. Превращения в стали при нагревании. Перегрев и пережег стали. Видманштеттовая струкрура
Термическая обработка. Превращения в стали при нагревании. Перегрев и пережег стали. Видманштеттовая струкрура Викторина по химии
Викторина по химии Алканы. Гомологический ряд
Алканы. Гомологический ряд Презентация по химии Химические уравнения Реакции обмена
Презентация по химии Химические уравнения Реакции обмена  Пестициды. Применение пестицидов
Пестициды. Применение пестицидов Минералы и горные породы
Минералы и горные породы Сложные вещества Выполнил ученик 8 класса КГООУ «Железногорская санаторно-лесная школа» Москальчук Павел Учитель химии и биол
Сложные вещества Выполнил ученик 8 класса КГООУ «Железногорская санаторно-лесная школа» Москальчук Павел Учитель химии и биол История возникновения химии
История возникновения химии Основные понятия, классификация, структура и свойства полимеров. (Лекция 1)
Основные понятия, классификация, структура и свойства полимеров. (Лекция 1) Мыло ручной работы Подготовила ученицы 11 класса Хахалева Юлия
Мыло ручной работы Подготовила ученицы 11 класса Хахалева Юлия  Урок в 8 классе
Урок в 8 классе Белки. Свойства белков. (Тема 2)
Белки. Свойства белков. (Тема 2) Металлы в живой приподе
Металлы в живой приподе Основы электрохимии
Основы электрохимии Разработка реактора для отопления домов путем извлечения водорода из воды
Разработка реактора для отопления домов путем извлечения водорода из воды Химия нефти и газа
Химия нефти и газа Основные характеристики клеев
Основные характеристики клеев Гетероциклдік қосылыстар
Гетероциклдік қосылыстар Профилактика интоксикаций медьсодержащими веществами
Профилактика интоксикаций медьсодержащими веществами Процесс электролиза
Процесс электролиза Гетероциклічні ароматичні сполуки
Гетероциклічні ароматичні сполуки Коррозия металлов
Коррозия металлов Кислоты. Классификация. Способы получения
Кислоты. Классификация. Способы получения Симметрия кристаллических решеток
Симметрия кристаллических решеток Липиды омыляемые и неомыляемые
Липиды омыляемые и неомыляемые Химия функциональных материалов. Адсорбционные материалы. Цеолиты
Химия функциональных материалов. Адсорбционные материалы. Цеолиты Классификация методов аналитической химии
Классификация методов аналитической химии Амфотерность. Амфотерные соединения
Амфотерность. Амфотерные соединения