Оксиды углерода Волкова Наталья Мироновна учитель химии МОУ СОШ № 138 с углубленным изучением отдельных предметов Октябрьског
Содержание
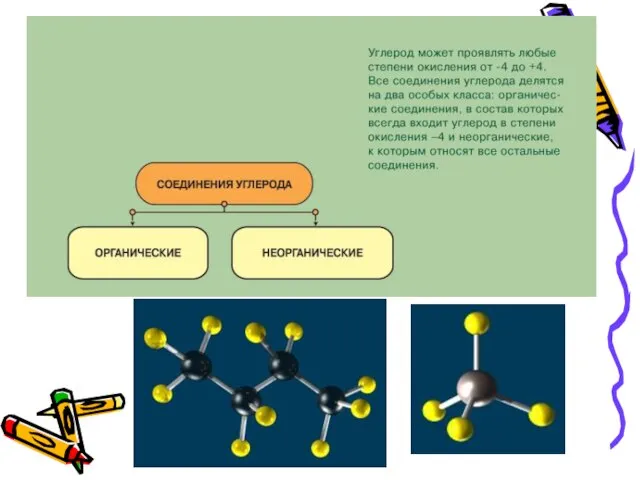
- 3. Оксиды углерода С СО СО2 Оксид углерода (II) оксид углерода (IV) или или угарный газ углекислый
- 4. Оксид углерода (II) иначе угарный газ — бесцветный, не имеющий запаха, плохо растворимый в воде ядовитый
- 5. Оксид углерода (IV) или углекислый газ – газ без цвета и запаха. Это кислотный оксид, ему
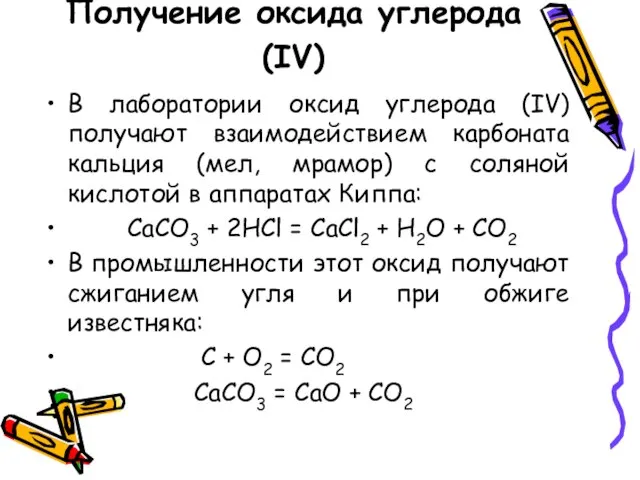
- 8. Получение оксида углерода (IV) В лаборатории оксид углерода (IV) получают взаимодействием карбоната кальция (мел, мрамор) с
- 10. Скачать презентацию





 Алканы. Этан - C₂H₆
Алканы. Этан - C₂H₆ Негативний вплив побутової хімії та шкідливих речовин на людину у приміщеннях Виконала учениця 11-Е класу Нечипоренко Марина
Негативний вплив побутової хімії та шкідливих речовин на людину у приміщеннях Виконала учениця 11-Е класу Нечипоренко Марина  Тест 1.Тип кристаллической решетки у белого фосфора…. а) молекулярный б) атомный в) ионный а) молекулярный Р4 2. У фосфора…..
Тест 1.Тип кристаллической решетки у белого фосфора…. а) молекулярный б) атомный в) ионный а) молекулярный Р4 2. У фосфора…..  Методы выделения, очистки, идентификации и изучения мембранных структур
Методы выделения, очистки, идентификации и изучения мембранных структур Комплексные соединения
Комплексные соединения Задачи по уравнениям реакций с алгоритмом (8 класс)
Задачи по уравнениям реакций с алгоритмом (8 класс) Химическая музыка
Химическая музыка Фосфор. Гипофосфатемия и гиперфосфатемия
Фосфор. Гипофосфатемия и гиперфосфатемия Теорія хімічної будови органічних сполук О.М. Бутлерова
Теорія хімічної будови органічних сполук О.М. Бутлерова  Ткаченко Ірина Іванівна, вчитель хімії Черкаської загальноосвітньої школи I-III ступенів № 21
Ткаченко Ірина Іванівна, вчитель хімії Черкаської загальноосвітньої школи I-III ступенів № 21  Классификация терпенов
Классификация терпенов Зелёные камни. Хризоберилл
Зелёные камни. Хризоберилл Место антацидов в современных схемах лечения кислотозависимых заболеваний
Место антацидов в современных схемах лечения кислотозависимых заболеваний Аттестационная работа. Программа элективного курса «Исследовательская проектная деятельность при изучении химии»
Аттестационная работа. Программа элективного курса «Исследовательская проектная деятельность при изучении химии» Литология. Кремнистые породы
Литология. Кремнистые породы Гидролиз. Применение гидролиза. (11 класс)
Гидролиз. Применение гидролиза. (11 класс) Алкиндер. Номенклатурасы, табиғатта кездесуі, физикалық және химиялық қасиеттері, алыну жолдары
Алкиндер. Номенклатурасы, табиғатта кездесуі, физикалық және химиялық қасиеттері, алыну жолдары Свойства основных липопротеинов (ЛП) плазмы крови
Свойства основных липопротеинов (ЛП) плазмы крови Прості речовини
Прості речовини  Гомо- и гетерополисахариды
Гомо- и гетерополисахариды Phase formation rules for high entropy alloys
Phase formation rules for high entropy alloys Аминокислоты и белки
Аминокислоты и белки Группа редкоземельных элементов
Группа редкоземельных элементов Аттестационная работа. Химия в нашей жизни
Аттестационная работа. Химия в нашей жизни Игра «Умники и умницы» Горячун Елена Сергеевна учитель химии МБОУ СОШ № 1 г. Сковородино
Игра «Умники и умницы» Горячун Елена Сергеевна учитель химии МБОУ СОШ № 1 г. Сковородино Задачник. Основные физические величины в химии
Задачник. Основные физические величины в химии Iodine
Iodine Количественные методы анализа риска
Количественные методы анализа риска