Содержание
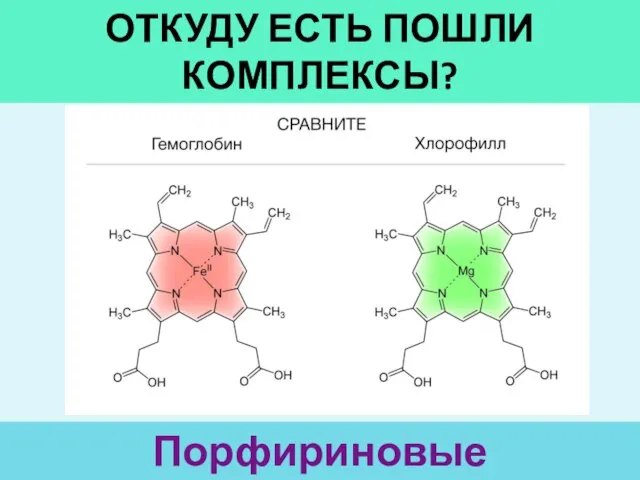
- 2. ОТКУДУ ЕСТЬ ПОШЛИ КОМПЛЕКСЫ? Порфириновые производные
- 3. ОТКУДУ ЕСТЬ ПОШЛИ КОМПЛЕКСЫ? Благородные металлы: Pt, Au, Ru H[AuCl4] Na[Au(CN)2]
- 4. СТРОЕНИЕ, СФЕРЫ Na2[Zn(OH)4]
- 5. СТРОЕНИЕ, СФЕРЫ K4[Fe(CN)6] [Ni(СО)4] [Ag(NH3)2]OH центральный атом (ц.а.) лиганды КЧ внутренняя сфера = комплекс внешняя сфера
- 6. ТЕРМИНОЛОГИЯ Комплексы – соединения, образованные в результате присоединения к данному иону/атому (ц.а.) молекул или ионов (лигандов)
- 7. ТЕРМИНОЛОГИЯ Ц.а. – акцептор ē (свободные ē орбитали) Лиганды – донор ē (молекула или ион), связанный
- 8. НОМЕНКЛАТУРА КС NaCl хлорид натрия Na3[Cr(OH)6] гексагидроксохромит/-ат натрия
- 9. НОМЕНКЛАТУРА КС K4[Fe(CN)6] ЖКС гексацианоферрат(III) калия [Ag(NH3)2]OH р-в Толленса гидроксид диамминсеребра(I) Анион, катион КЧ, анионные лиганды,
- 10. ИЗОМЕРИЯ В НЕОРГЕ? WTF [CrCl3(H2O)3]∙3H2O Тригидрат трихлоротриаквахром [CrCl2(H2O)4]Сl∙2H2O Дигидрат хлорида дихлоротетрааквахрома (III)
- 11. ИЗОМЕРИЯ В НЕОРГЕ? WTF [CrCl(H2O)5]Cl2∙H2O Моногидрат хлорида хлоропентааквахрома (III) [Cr(H2O)6]Сl3 Хлорид гексааквахрома(III) Все 4 в-ва описываются
- 12. ЛАДНО, ПОЛЕГЧЕ: НОМЕНКЛАТУРА Na2[Be(OH)4] Тетрагидроксобериллат натрия Na2[Zn(OH)4] тетрагидроксоцинкат натрия Na2[Pb(OH)4] attention тетрагидроксоплюмбат натрия
- 13. БОК О БОК: Fe, Al, Cr? Ну, почти… Na[Al(OH)4] тетрагидроксоалюминат натрия Na3[Cr(OH)6] ¡six! гексагидроксобериллат натрия Na3[Fe(OH)6]
- 14. ВСЕ ЖЕ БОК О БОК: Fe, Al, Cr __ + H2SO4(р.) = FeSO4 + H2 __
- 15. БОК О БОК: Fe, Al, Cr? Ну, почти… Полный гидролиз: здесь Al = Fe = Cr
- 16. БОК О БОК: Fe, Al, Cr? Ну, почти… Полный гидролиз сульфидов: здесь Al = Cr Fe(III)
- 17. Fe(OH)3 – АМФОТЕРНЫЙ? Zn(OH)2 + NaOHр-р + NaOH (t°) Be(OH)2 + NaOHр-р + NaOH (t°) Pb(OH)2
- 18. ПУТЕШЕСТВИЕ ТУДА И ОБРАТНО Al3+ Al(OH)3 [Al(OH)4]- Al(OH)3 Al3+
- 19. PRACTICE Al2(SO4)3 Al(OH)3 Na[Al(OH)4] Al(OH)3 AlCl3
- 20. НЕ ПРЕНЕБРЕГАЙ КЭФАМИ AlCl3 + 3NaOH = Al(OH)3 + 3NaCl Al(OH)3 + NaOH = Na[Al(OH)4] Na[Al(OH)4]
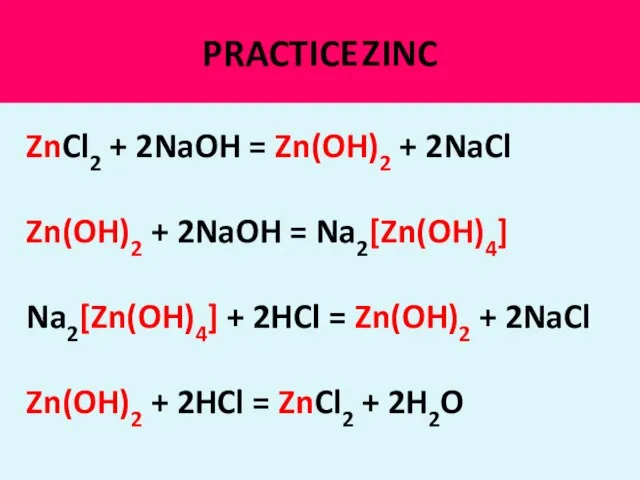
- 21. PRACTICE ZINC ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl Zn(OH)2 + 2NaOH = Na2[Zn(OH)4] Na2[Zn(OH)4] +
- 22. РАЗРУШЕНИЕ КОМПЛЕКСОВ Частичное Na2[Zn(OH)4] + 2HCl(нед.) = Zn(OH)2 + 2NaCl Na2[Zn(OH)4] + СO2 = Zn(OH)2 +
- 23. ЛАДНО, ЛАДНО, ПОЛЕГЧЕ [Ag(NH3)2]OH гидроксид диамминсеребра(I) [Cu(NH3)4](OH)2 (р-в Швейцера) гидроксид тетраамминмеди(II) Лиганд NH3 – аммин (не
- 24. ГИДРОКСИД Ag ИЛИ ОКСИД Ag? Большинство осаждений щелочью: Mg(NO3)2 + 2NaOH = Mg(OH)2 + 2NaNO3 Но:
- 25. РЕАКТИВ ТОЛЛЕНСА Пишем аммониевую соль, а не к-ту Серебряное зеркало 2[Ag(NH3)2]OH + RCHO = 2Аg +
- 26. РЕАКТИВ ТОЛЛЕНСА Слабокислотные св-ва алкинов Терминальные алкины [Ag(NH3)2]OH + RC≡CH = RC≡CAg + 2NH3 + H2O
- 27. РЕАКТИВ ТОЛЛЕНСА Взрывчатые Терминальные алкины Only ONE: дважды терминальный
- 28. РЕАКТИВ ШВЕЙЦЕРА Ну цвет-то какой!!! Свежеосажденный или иначе сложнее р-рять: CuSO4 + 2NaOH = Cu(OH)2 +
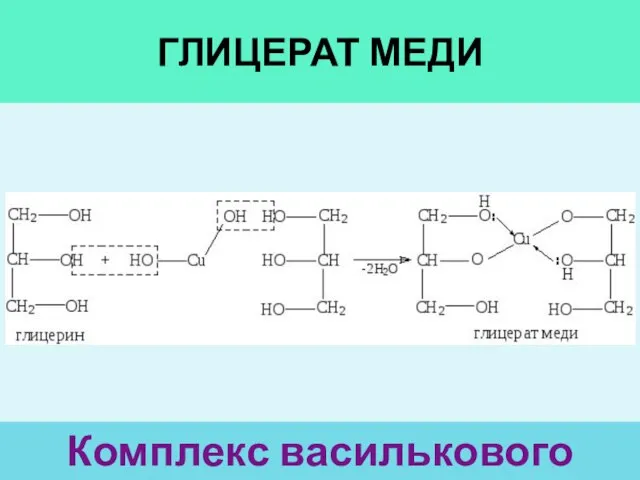
- 29. ГЛИЦЕРАТ МЕДИ Комплекс василькового цвета
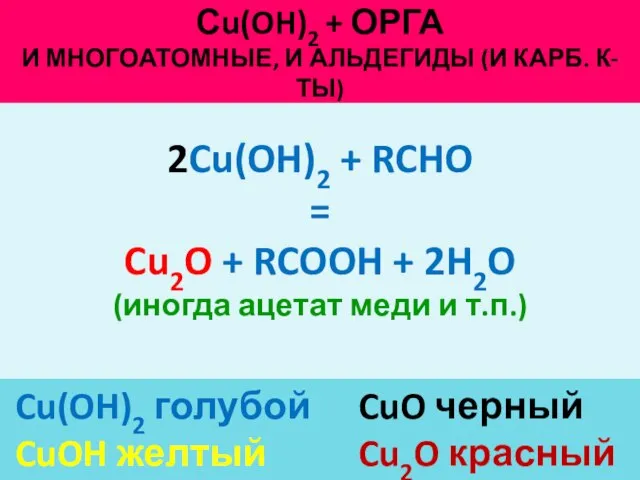
- 30. Сu(OH)2 + ОРГА И МНОГОАТОМНЫЕ, И АЛЬДЕГИДЫ (И КАРБ. К-ТЫ) Cu(OH)2 голубой CuO черный CuOH желтый
- 31. Freddy Hg HgCl2 + 2KI = HgI2↓ + 2KCl HgI2 + 2KI = K2[HgI4] Реактив Несслера
- 33. Скачать презентацию
![ОТКУДУ ЕСТЬ ПОШЛИ КОМПЛЕКСЫ? Благородные металлы: Pt, Au, Ru H[AuCl4] Na[Au(CN)2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/519963/slide-2.jpg)
![СТРОЕНИЕ, СФЕРЫ Na2[Zn(OH)4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/519963/slide-3.jpg)
![СТРОЕНИЕ, СФЕРЫ K4[Fe(CN)6] [Ni(СО)4] [Ag(NH3)2]OH центральный атом (ц.а.) лиганды КЧ внутренняя сфера = комплекс внешняя сфера](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/519963/slide-4.jpg)


![НОМЕНКЛАТУРА КС NaCl хлорид натрия Na3[Cr(OH)6] гексагидроксохромит/-ат натрия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/519963/slide-7.jpg)
![НОМЕНКЛАТУРА КС K4[Fe(CN)6] ЖКС гексацианоферрат(III) калия [Ag(NH3)2]OH р-в Толленса гидроксид диамминсеребра(I)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/519963/slide-8.jpg)
![ИЗОМЕРИЯ В НЕОРГЕ? WTF [CrCl3(H2O)3]∙3H2O Тригидрат трихлоротриаквахром [CrCl2(H2O)4]Сl∙2H2O Дигидрат хлорида дихлоротетрааквахрома (III)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/519963/slide-9.jpg)
![ИЗОМЕРИЯ В НЕОРГЕ? WTF [CrCl(H2O)5]Cl2∙H2O Моногидрат хлорида хлоропентааквахрома (III) [Cr(H2O)6]Сl3 Хлорид](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/519963/slide-10.jpg)
![ЛАДНО, ПОЛЕГЧЕ: НОМЕНКЛАТУРА Na2[Be(OH)4] Тетрагидроксобериллат натрия Na2[Zn(OH)4] тетрагидроксоцинкат натрия Na2[Pb(OH)4] attention тетрагидроксоплюмбат натрия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/519963/slide-11.jpg)
![БОК О БОК: Fe, Al, Cr? Ну, почти… Na[Al(OH)4] тетрагидроксоалюминат натрия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/519963/slide-12.jpg)




![ПУТЕШЕСТВИЕ ТУДА И ОБРАТНО Al3+ Al(OH)3 [Al(OH)4]- Al(OH)3 Al3+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/519963/slide-17.jpg)
![PRACTICE Al2(SO4)3 Al(OH)3 Na[Al(OH)4] Al(OH)3 AlCl3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/519963/slide-18.jpg)

![РАЗРУШЕНИЕ КОМПЛЕКСОВ Частичное Na2[Zn(OH)4] + 2HCl(нед.) = Zn(OH)2 + 2NaCl Na2[Zn(OH)4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/519963/slide-21.jpg)
![ЛАДНО, ЛАДНО, ПОЛЕГЧЕ [Ag(NH3)2]OH гидроксид диамминсеребра(I) [Cu(NH3)4](OH)2 (р-в Швейцера) гидроксид тетраамминмеди(II)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/519963/slide-22.jpg)

![РЕАКТИВ ТОЛЛЕНСА Пишем аммониевую соль, а не к-ту Серебряное зеркало 2[Ag(NH3)2]OH](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/519963/slide-24.jpg)
![РЕАКТИВ ТОЛЛЕНСА Слабокислотные св-ва алкинов Терминальные алкины [Ag(NH3)2]OH + RC≡CH = RC≡CAg + 2NH3 + H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/519963/slide-25.jpg)


![Freddy Hg HgCl2 + 2KI = HgI2↓ + 2KCl HgI2 + 2KI = K2[HgI4] Реактив Несслера](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/519963/slide-30.jpg)
 Презентация по Химии "Презентація про мене" - скачать смотреть
Презентация по Химии "Презентація про мене" - скачать смотреть  Фосфор
Фосфор Хімія у створенні нових матеріалів та побуті
Хімія у створенні нових матеріалів та побуті ОГЭ, вопрос 16 1-4
ОГЭ, вопрос 16 1-4 Начальные этапы обмена липидов
Начальные этапы обмена липидов Полимеры. Пластмассы. Волокна. Цели: - узнать что такое пластмассы, волокна их отличие от полимеров; - изучить классификацию пл
Полимеры. Пластмассы. Волокна. Цели: - узнать что такое пластмассы, волокна их отличие от полимеров; - изучить классификацию пл Презентация по Химии "«Сахароза»" - скачать смотреть бесплатно
Презентация по Химии "«Сахароза»" - скачать смотреть бесплатно Щавелевая кислота
Щавелевая кислота Хімічний елемент Літій
Хімічний елемент Літій Кислородные соединения азота. Азотная кислота
Кислородные соединения азота. Азотная кислота Предельные одноатомные спирты
Предельные одноатомные спирты Серебра нитрат и другие препараты серебра. Ртути окись желтая
Серебра нитрат и другие препараты серебра. Ртути окись желтая Посвящение в химики!
Посвящение в химики! Гормоны, как лекарственные вещества. Анализ, применение и хранение. (Тема 4)
Гормоны, как лекарственные вещества. Анализ, применение и хранение. (Тема 4) Узинская ООШ исслед.работа Лобановой Елизаветы
Узинская ООШ исслед.работа Лобановой Елизаветы ТБ в школе и в быту
ТБ в школе и в быту Твердые тела и их свойства
Твердые тела и их свойства  Геология и геохимия нефти и газа
Геология и геохимия нефти и газа Азотсодержащие органические соединения
Азотсодержащие органические соединения Lekcii_ - 2017-lech_ped 11
Lekcii_ - 2017-lech_ped 11 Юные химики
Юные химики Курсовая работа. Влияние микроэлементов на физиологические процессы
Курсовая работа. Влияние микроэлементов на физиологические процессы Материаловедение. Текстильные волокна, пряжа и ткань
Материаловедение. Текстильные волокна, пряжа и ткань Electrochemistry. Oxidation-reduction equilibrium in water solutions
Electrochemistry. Oxidation-reduction equilibrium in water solutions Презентация по Химии "Углерод" - скачать смотреть
Презентация по Химии "Углерод" - скачать смотреть  Химически опасные объекты (ХОО)
Химически опасные объекты (ХОО) Теория химического строения А. М. Бутлерова. Часть III
Теория химического строения А. М. Бутлерова. Часть III Платина. Свойства
Платина. Свойства