Содержание
- 2. Хроматографические параметры Цели разделения и анализа веществ пробы:
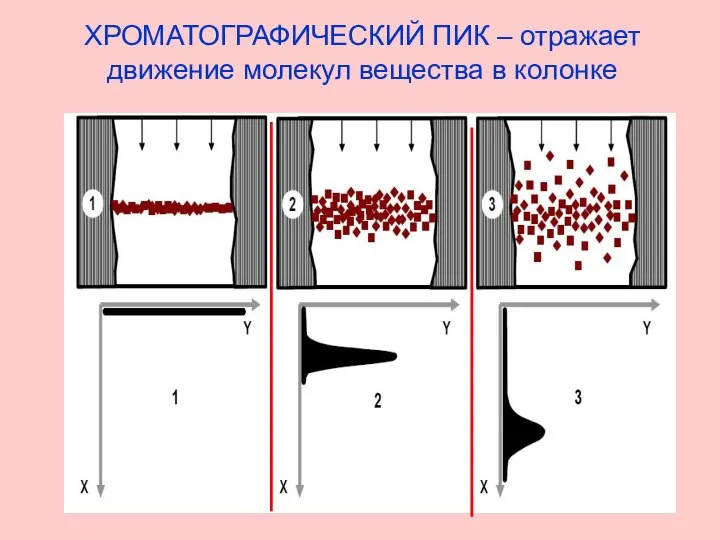
- 3. ХРОМАТОГРАФИЧЕСКИЙ ПИК – отражает движение молекул вещества в колонке
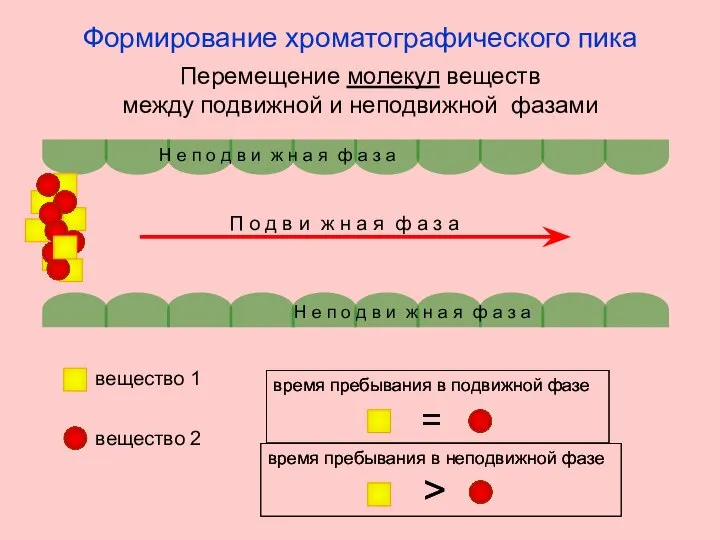
- 4. Н е п о д в и ж н а я ф а з а Н
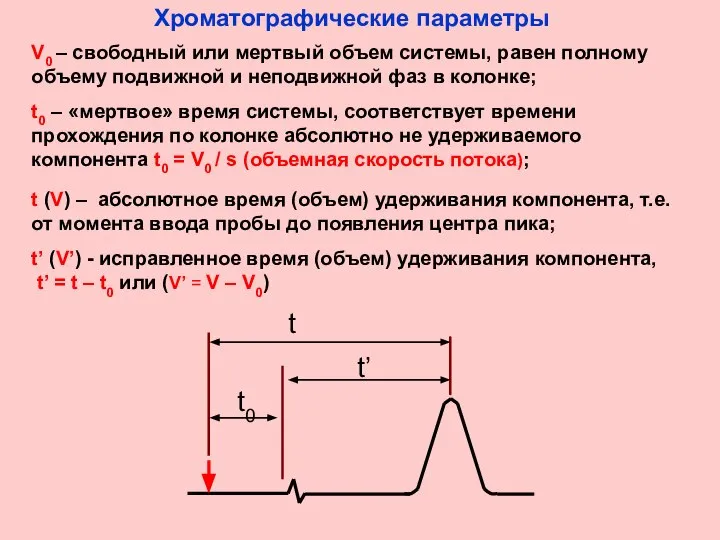
- 5. V0 – свободный или мертвый объем системы, равен полному объему подвижной и неподвижной фаз в колонке;
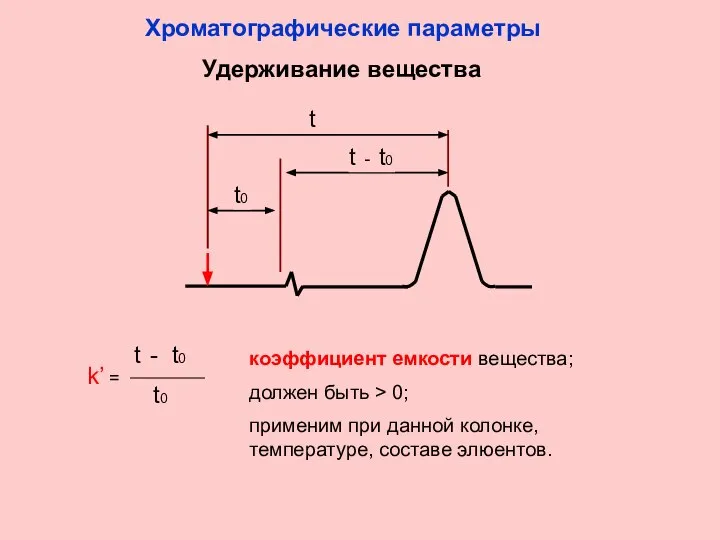
- 6. Удерживание вещества t t - t0 t0 коэффициент емкости вещества; должен быть > 0; применим при
- 7. t1 t2 k’1 k’2 Коэффициент селективности, определяется соотношением исправленных времен удерживания, должен быть ≠ 1. Хроматографические
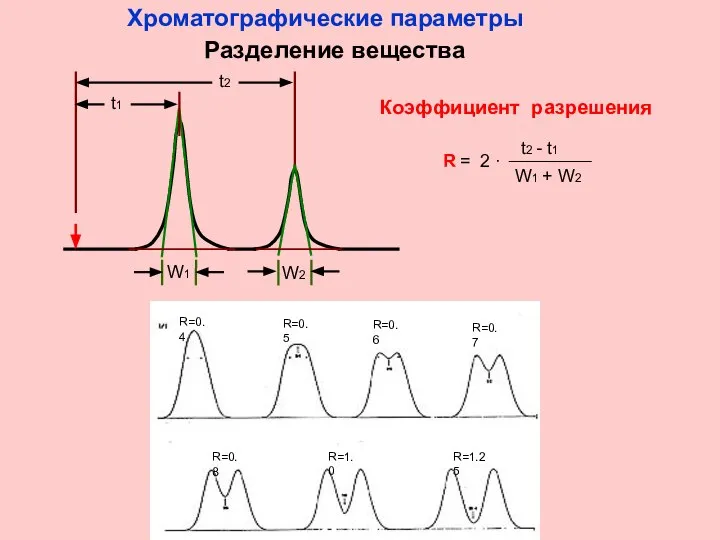
- 8. Коэффициент разрешения Хроматографические параметры Разделение вещества
- 9. ЭФФЕКТИВНОСТЬ Число теоретических тарелок (N) – физический смысл: число элементарных актов сорбции-десорбции, произошедших с веществом при
- 10. Расчет числа т.т. N = 5.545 ( t / W0.5)2 Чем эффективнее колонка, тем уже пик,
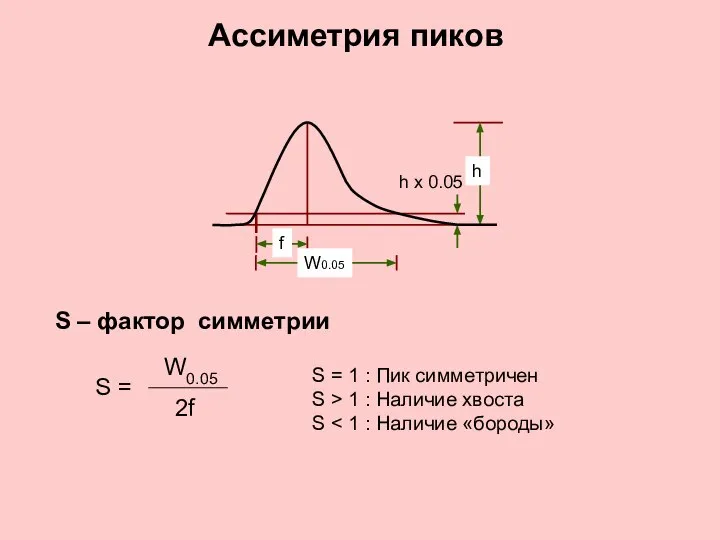
- 11. Ассиметрия пиков S – фактор симметрии S = 2f W0.05 f W0.05 h x 0.05 h
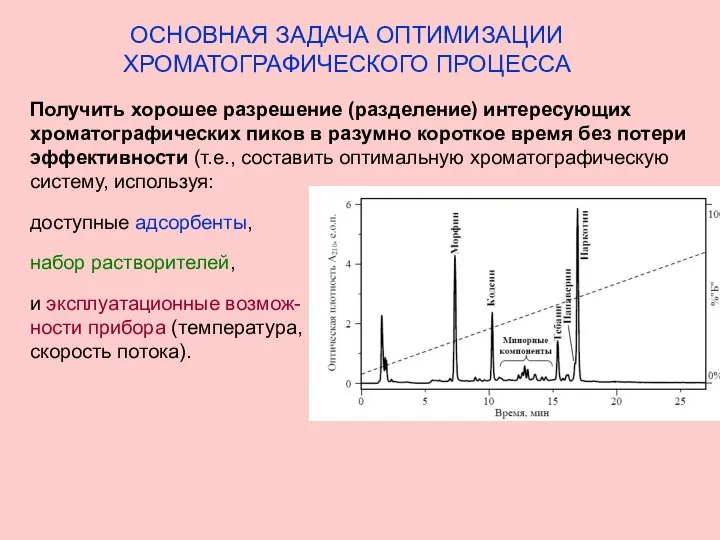
- 12. ОСНОВНАЯ ЗАДАЧА ОПТИМИЗАЦИИ ХРОМАТОГРАФИЧЕСКОГО ПРОЦЕССА Получить хорошее разрешение (разделение) интересующих хроматографических пиков в разумно короткое время
- 13. ОПТИМИЗАЦИЯ ХРОМАТОГРАФИЧЕСКОГО ПРОЦЕССА Выбор вида хроматографии Определяется: а) задачей исследования, б) свойствами, типом разделяемых веществ. Определение
- 14. Выбор вида хроматографии для индивидуальных компонентов: газовая или высокоэффективная жидкостная? п о л я р н
- 15. Примеры использования различных видов хроматографии для разделения биоорганических соединений и органических загрязнителей: Классы липидов – ТСХ
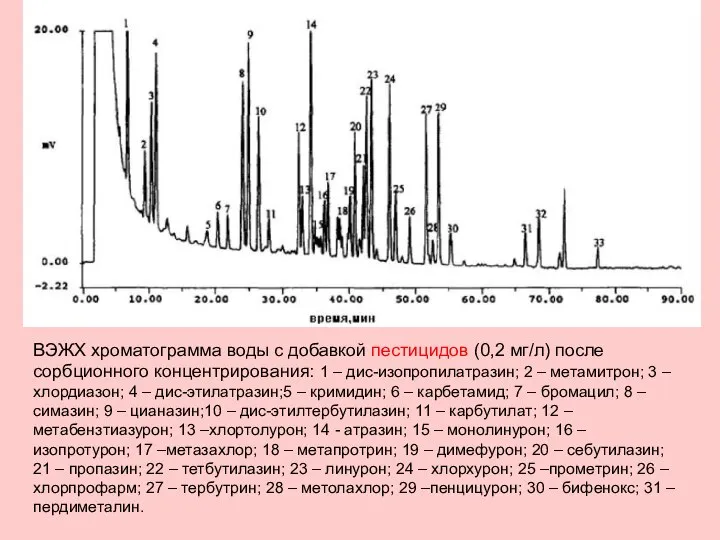
- 16. ВЭЖХ хроматограмма воды с добавкой пестицидов (0,2 мг/л) после сорбционного концентрирования: 1 – дис-изопропилатразин; 2 –
- 17. ОПТИМИЗАЦИЯ ХРОМАТОГРАФИЧЕСКОГО ПРОЦЕССА Элюотропный ряд - повышение силы элюента в ВЭЖХ, ε Выбор состава элюента: может
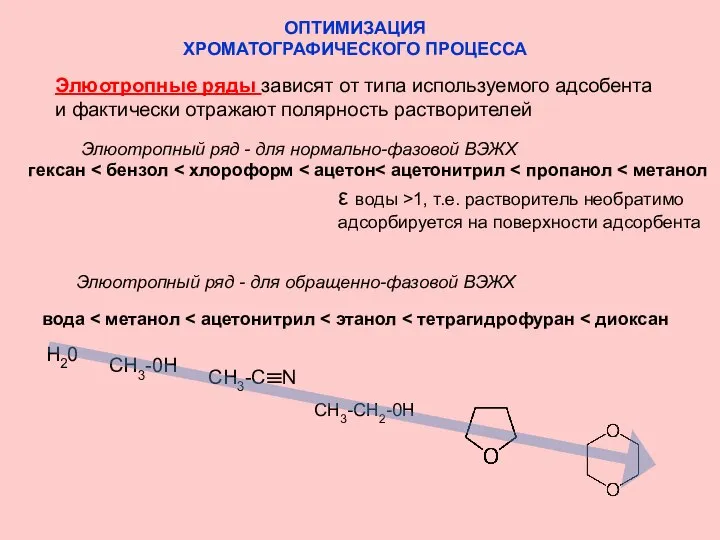
- 18. ОПТИМИЗАЦИЯ ХРОМАТОГРАФИЧЕСКОГО ПРОЦЕССА Элюотропные ряды зависят от типа используемого адсобента и фактически отражают полярность растворителей Элюотропный
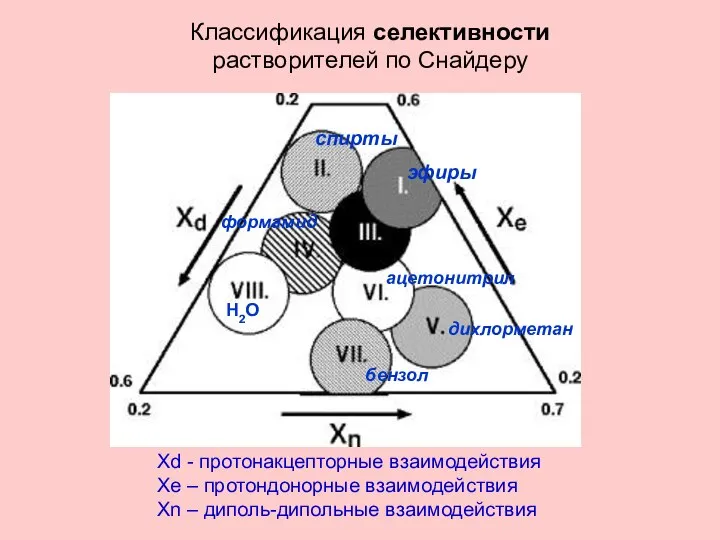
- 19. ацетонитрил спирты Н2О Классификация селективности растворителей по Снайдеру Xd - протонакцепторные взаимодействия Xe – протондонорные взаимодействия
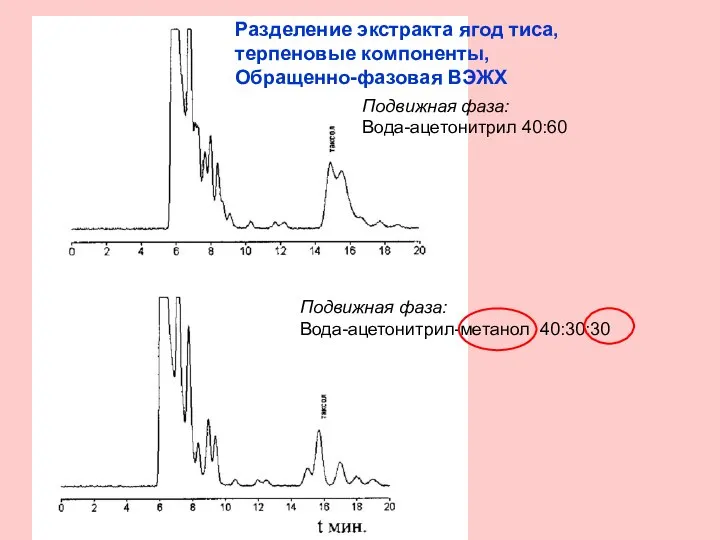
- 20. Разделение экстракта ягод тиса, терпеновые компоненты, Обращенно-фазовая ВЭЖХ Подвижная фаза: Вода-ацетонитрил 40:60 Подвижная фаза: Вода-ацетонитрил-метанол 40:30:30
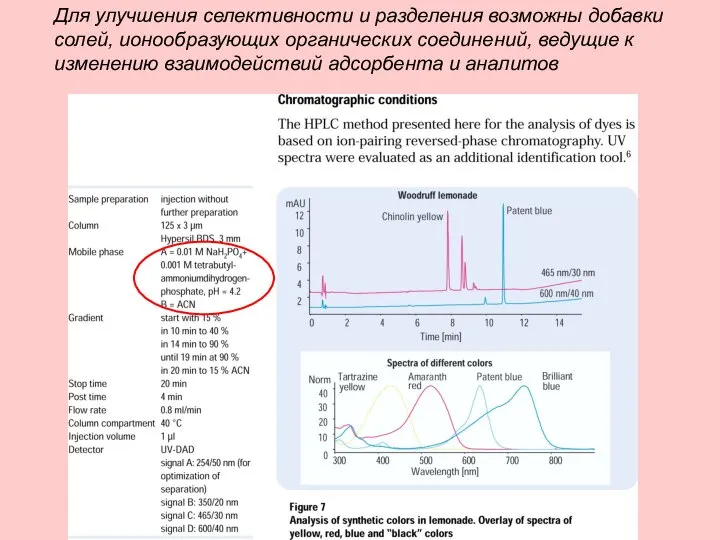
- 21. Для улучшения селективности и разделения возможны добавки солей, ионообразующих органических соединений, ведущие к изменению взаимодействий адсорбента
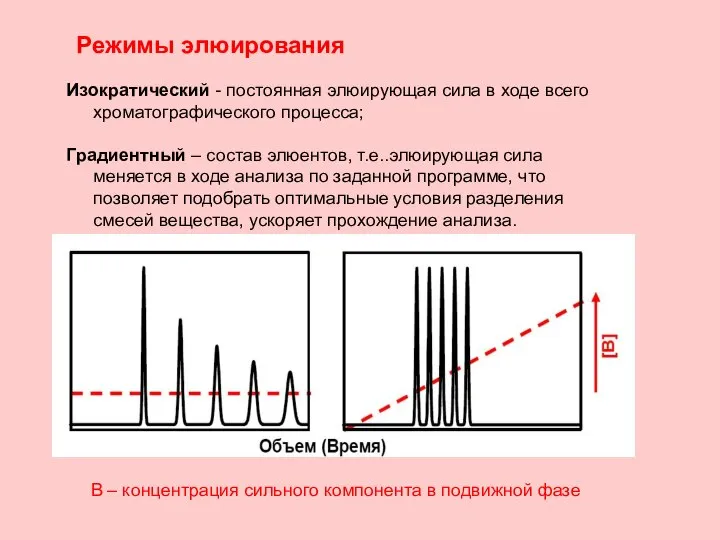
- 22. Режимы элюирования Изократический - постоянная элюирующая сила в ходе всего хроматографического процесса; Градиентный – состав элюентов,
- 23. Градиентный режим - состав элюента в процессе разделения компонентов изменяется по заданному режиму.
- 24. Температурные режимы в газовой хроматографии подобны режимам элюирования в ВЭЖХ Изотермальный (ГХ) ~ Изократический (ВЭЖХ) Програмирование
- 25. ОПТИМИЗАЦИЯ: ВЛИЯНИЕ ТЕМПЕРАТУРЫ VR = V0+V0*k' lgk' = a/T + b где Т – абсолютная температура
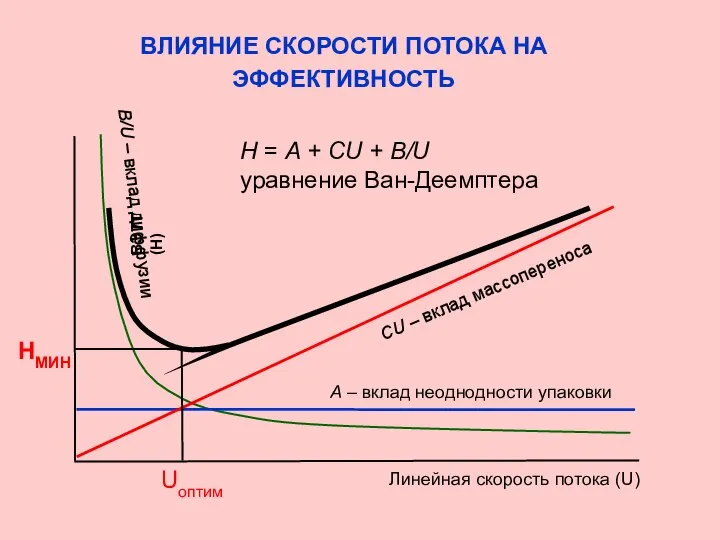
- 26. ВЛИЯНИЕ СКОРОСТИ ПОТОКА НА ЭФФЕКТИВНОСТЬ Основные причины размывания пиков Неоднородность потока по сечению колонки Влияние этого
- 27. ВЛИЯНИЕ СКОРОСТИ ПОТОКА НА ЭФФЕКТИВНОСТЬ НМИН ВЭТТ (Н) А – вклад неоднодности упаковки СU – вклад
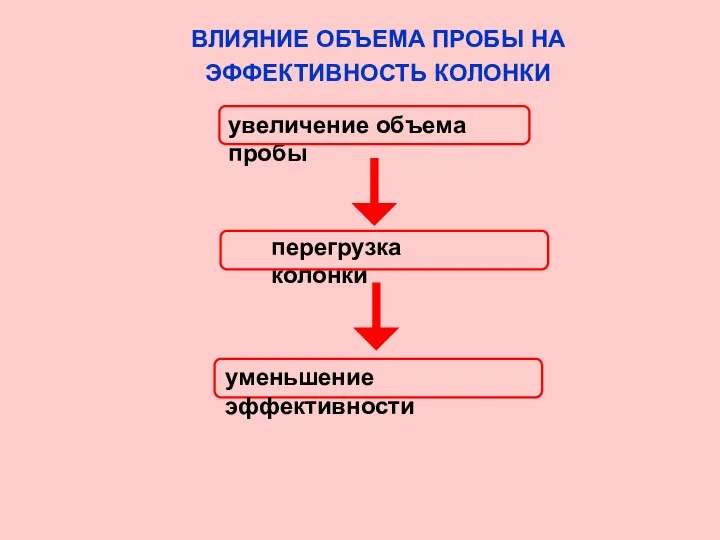
- 28. ВЛИЯНИЕ ОБЪЕМА ПРОБЫ НА ЭФФЕКТИВНОСТЬ КОЛОНКИ увеличение объема пробы перегрузка колонки уменьшение эффективности
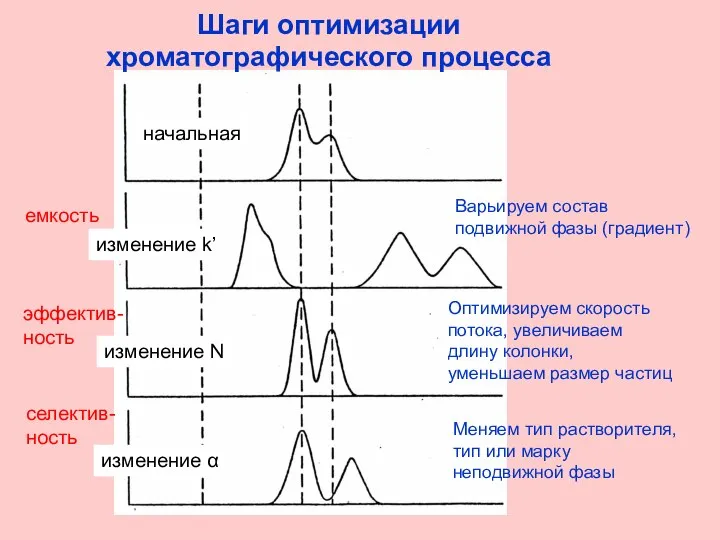
- 29. Шаги оптимизации хроматографического процесса начальная изменение k’ изменение N изменение α емкость эффектив- ность селектив- ность
- 30. КОЛИЧЕСТВЕННЫЙ АНАЛИЗ Задача: определение содержания одного или нескольких компонентов в пробе Мера количества вещества в хроматографии:
- 31. Методы количественного анализа нормализация; абсолютная калибровка по внешнему стандарту; метод добавок; калибровка по внутреннему стандарту.
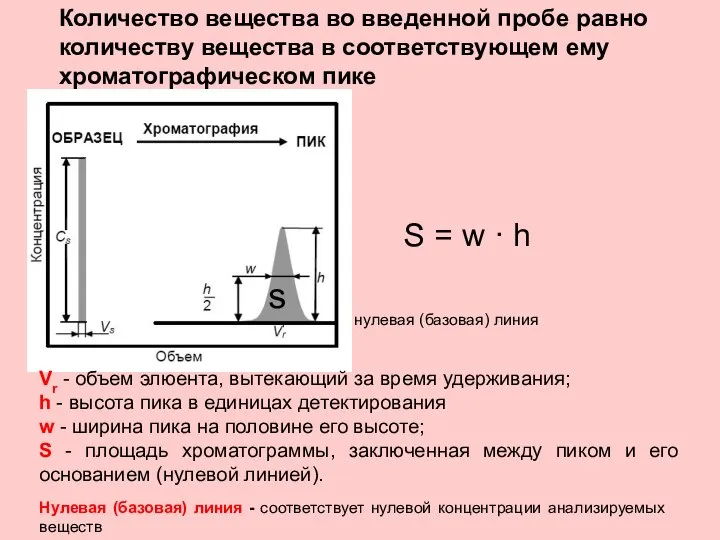
- 32. Количество вещества во введенной пробе равно количеству вещества в соответствующем ему хроматографическом пике нулевая (базовая) линия
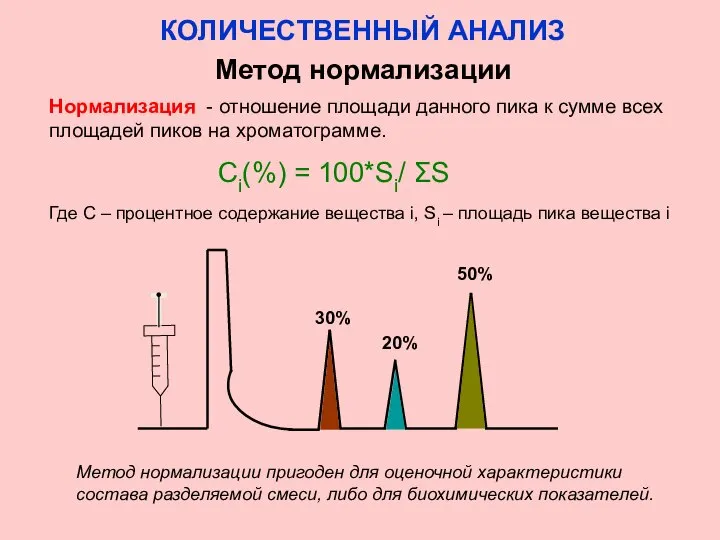
- 33. КОЛИЧЕСТВЕННЫЙ АНАЛИЗ Метод нормализации Нормализация - отношение площади данного пика к сумме всех площадей пиков на
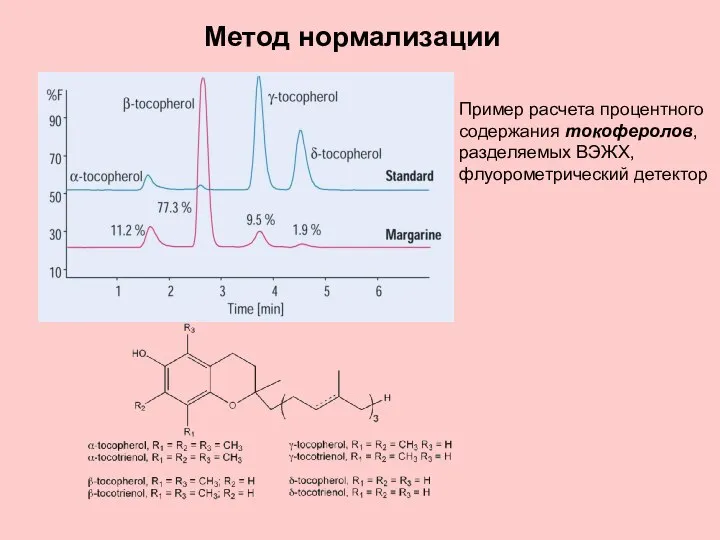
- 34. Метод нормализации Пример расчета процентного содержания токоферолов, разделяемых ВЭЖХ, флуорометрический детектор
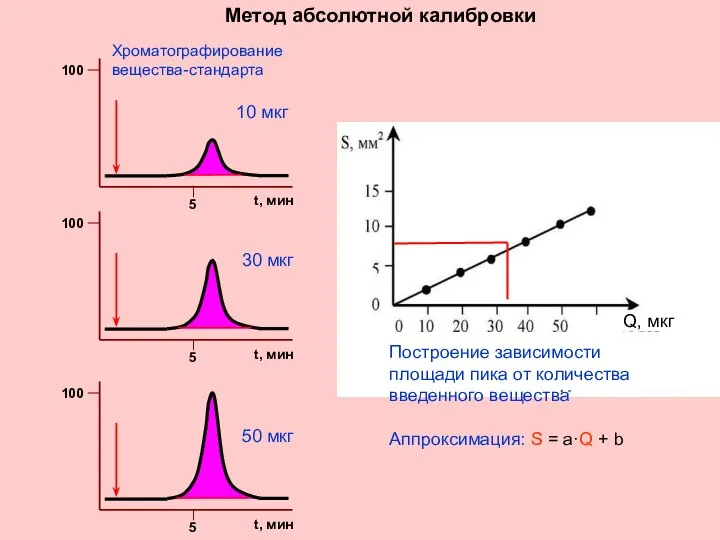
- 35. КОЛИЧЕСТВЕННЫЙ АНАЛИЗ Метод абсолютной калибровки Для реализации метода необходимо анализируемое вещество в чистом виде - стандарт
- 36. Q, мкг Метод абсолютной калибровки Построение зависимости площади пика от количества введенного вещества Аппроксимация: S =
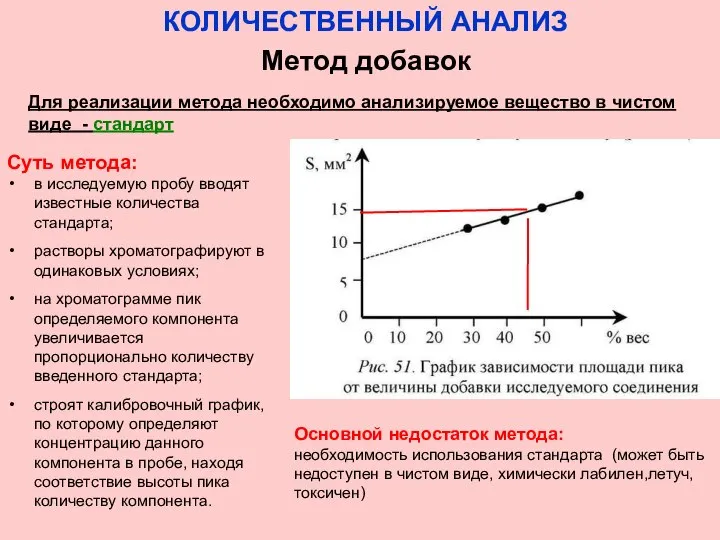
- 37. КОЛИЧЕСТВЕННЫЙ АНАЛИЗ Метод добавок Для реализации метода необходимо анализируемое вещество в чистом виде - стандарт Суть
- 38. КОЛИЧЕСТВЕННЫЙ АНАЛИЗ Метод внутреннего стандарта Для реализации метода необходимо вещество в чистом виде, по свойствам близкое
- 40. Скачать презентацию
















 Щелочные металлы
Щелочные металлы Химическая связь
Химическая связь Синтез и свойства кукурбитурилов
Синтез и свойства кукурбитурилов КАЛЬЦИЙ Ca 9 класс
КАЛЬЦИЙ Ca 9 класс Альдегиды и кетоны
Альдегиды и кетоны Основные классы неорганических соединений
Основные классы неорганических соединений Производные фенола: танины
Производные фенола: танины Основы молекулярной генетики. Генетические механизмы. Биосинтез белков и нуклеиновых кислот. (Лекция 3)
Основы молекулярной генетики. Генетические механизмы. Биосинтез белков и нуклеиновых кислот. (Лекция 3) Силикатная промышленность
Силикатная промышленность Химический КВН
Химический КВН «Волшебный» витамин или химические элементы в живой клетке
«Волшебный» витамин или химические элементы в живой клетке Неметаллы: атомы и простые вещества. Кислород, озон, воздух
Неметаллы: атомы и простые вещества. Кислород, озон, воздух Вредное воздействие нитратов на организм человека Выполнила: ученица 10 класса «А» Средней школы №1120
Вредное воздействие нитратов на организм человека Выполнила: ученица 10 класса «А» Средней школы №1120  Щёлочноземельные металлы
Щёлочноземельные металлы Химические элементы космоса.
Химические элементы космоса. Алканы. Гомологический ряд
Алканы. Гомологический ряд Методы разделения белковых смесей. Электрофорез
Методы разделения белковых смесей. Электрофорез Нітрати у харчових продуктах
Нітрати у харчових продуктах  Основные понятия химии
Основные понятия химии Альдегиды и кетоны
Альдегиды и кетоны Основы кристаллографии
Основы кристаллографии Ферменти
Ферменти Введение. Источники сырья для лекарственных веществ и препаратов. Понятие органический синтез. Полный органический синтез
Введение. Источники сырья для лекарственных веществ и препаратов. Понятие органический синтез. Полный органический синтез Переводной экзамен по химии «Качественные реакции в органической химии» Толмачевой Кати 11а
Переводной экзамен по химии «Качественные реакции в органической химии» Толмачевой Кати 11а Автомобильные бензины и дизельное топливо
Автомобильные бензины и дизельное топливо Ионно-координационная полимеризация
Ионно-координационная полимеризация Химические реактивы
Химические реактивы Урок « Магнитные свойства вещества. Магнитное поле Земли» в 11 классе.
Урок « Магнитные свойства вещества. Магнитное поле Земли» в 11 классе.