Содержание
- 2. Влияние изменения внешних условий на положение равновесия или принцип Ле-Шателье – Брауна (предложенного в 1884 году
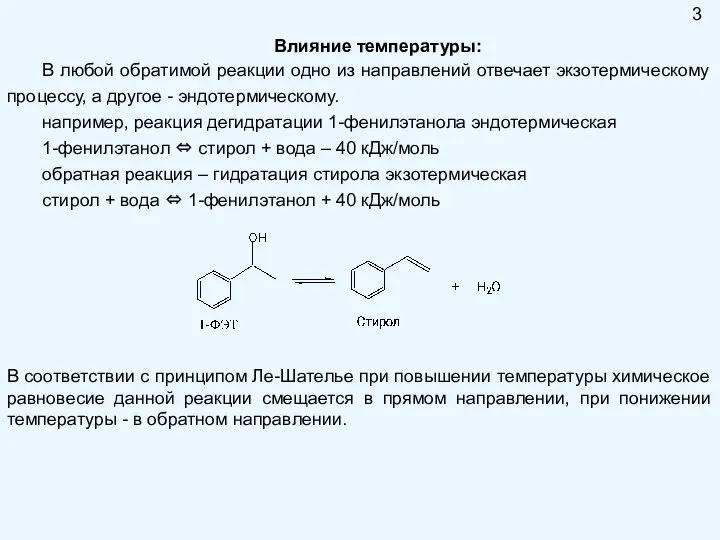
- 3. Влияние температуры: В любой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое - эндотермическому.
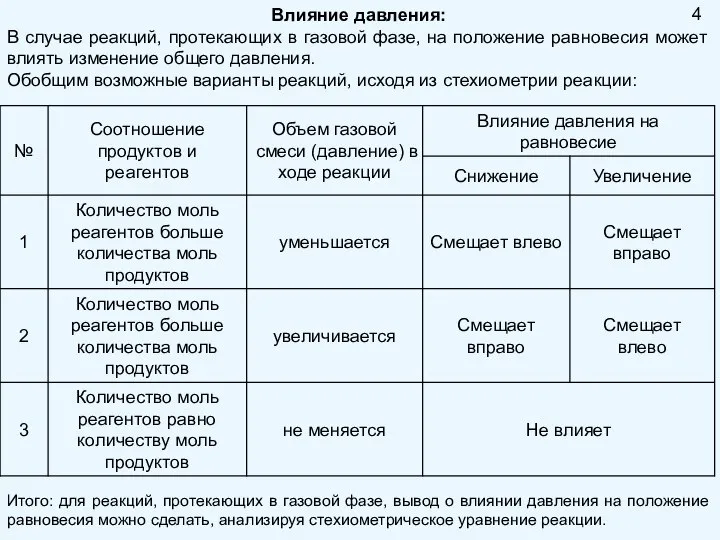
- 4. Влияние давления: В случае реакций, протекающих в газовой фазе, на положение равновесия может влиять изменение общего
- 5. N2+3H2 ⇔ 2 NH3 C2H5OH ⇔ C2H4 + H2O C2H5OH + C2H5OH ⇔ (C2H5)2O + H2O
- 6. Введение в газофазную систему инертного разбавителя (инертного в данных условиях газа), при условии, что общее давление
- 7. N2+3H2 ⇔ 2 NH3 C2H5OH ⇔ C2H4 + H2O C2H5OH + C2H5OH ⇔ (C2H5)2O + H2O
- 8. Влияние концентрации: Введение в равновесную систему дополнительного количества одного из компонентов сдвигает равновесие в направлении, которое
- 9. Количественная оценка положения равновесия Для количественной оценки положения равновесия (влияния внешних условий на положение равновесия) используем
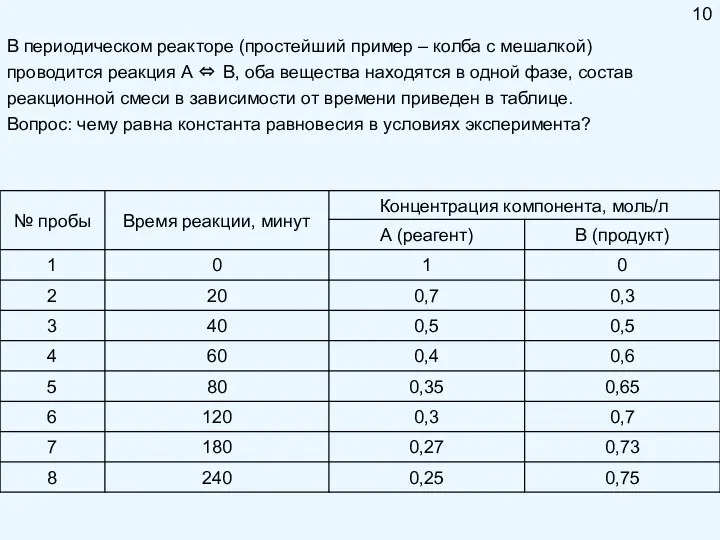
- 10. В периодическом реакторе (простейший пример – колба с мешалкой) проводится реакция А ⇔ B, оба вещества
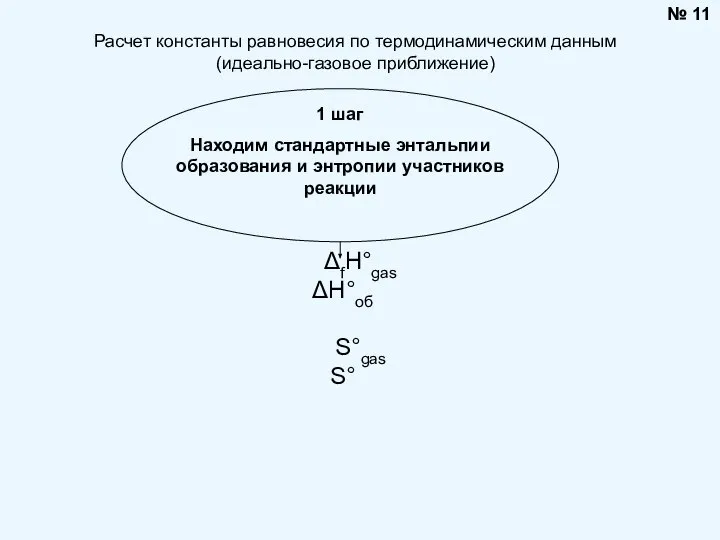
- 11. № 11 1 шаг Находим стандартные энтальпии образования и энтропии участников реакции Расчет константы равновесия по
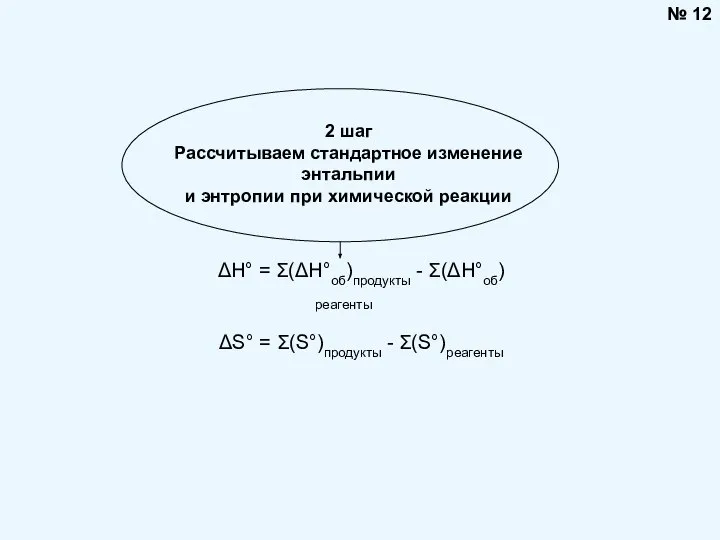
- 12. № 12 2 шаг Рассчитываем стандартное изменение энтальпии и энтропии при химической реакции ΔH° = Σ(ΔH°об)продукты
- 13. № 13 3 шаг Рассчитываем изменение энергии Гиббса при химической реакции Строго только для 298 К:
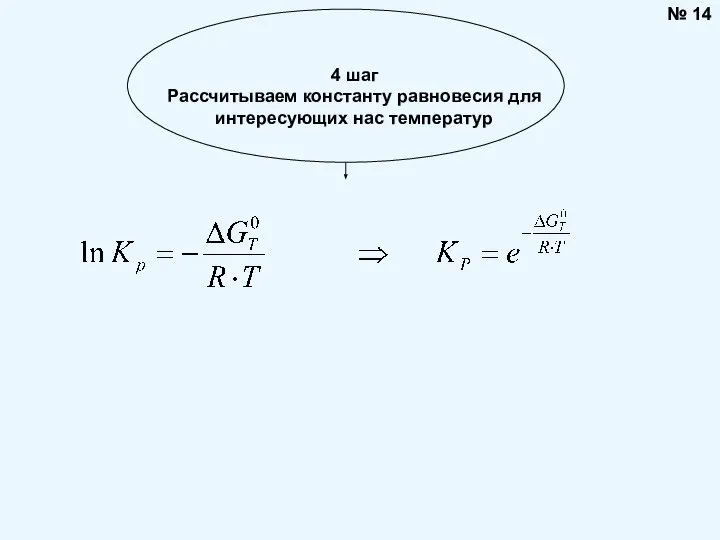
- 14. № 14 4 шаг Рассчитываем константу равновесия для интересующих нас температур
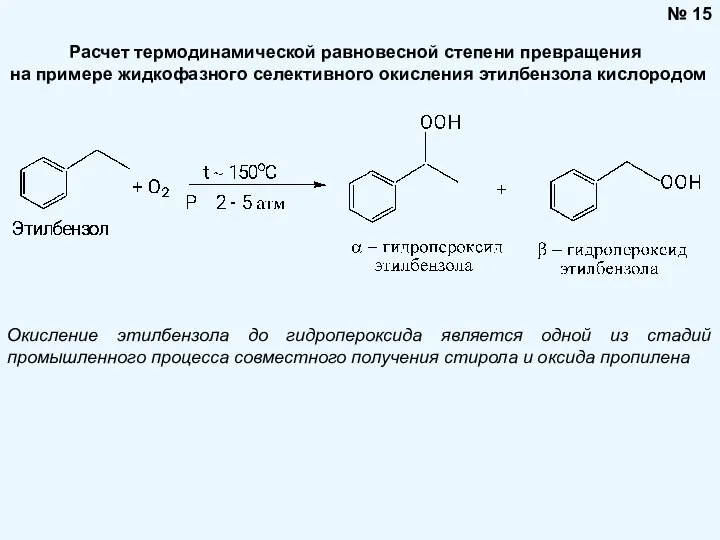
- 15. Расчет термодинамической равновесной степени превращения на примере жидкофазного селективного окисления этилбензола кислородом № 15 Окисление этилбензола
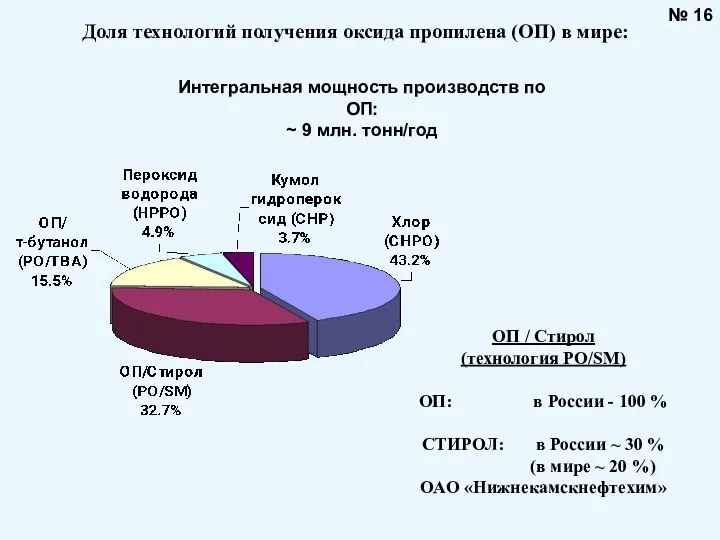
- 16. № 16 Интегральная мощность производств по ОП: ~ 9 млн. тонн/год Доля технологий получения оксида пропилена
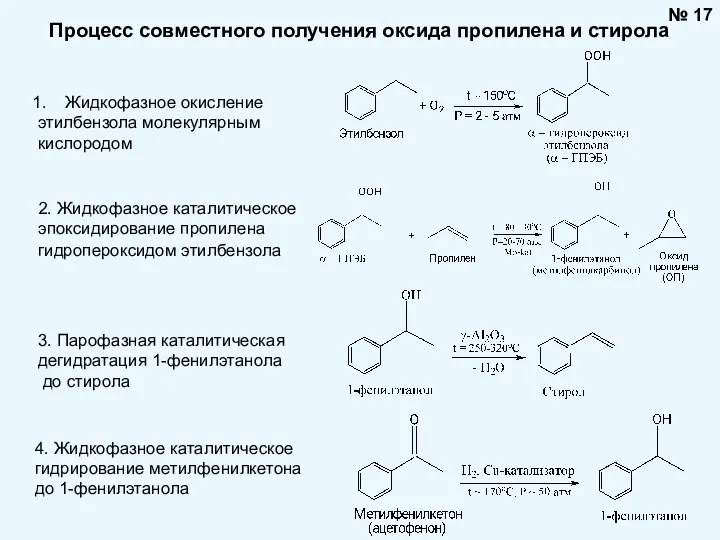
- 17. Процесс совместного получения оксида пропилена и стирола Жидкофазное окисление этилбензола молекулярным кислородом 2. Жидкофазное каталитическое эпоксидирование
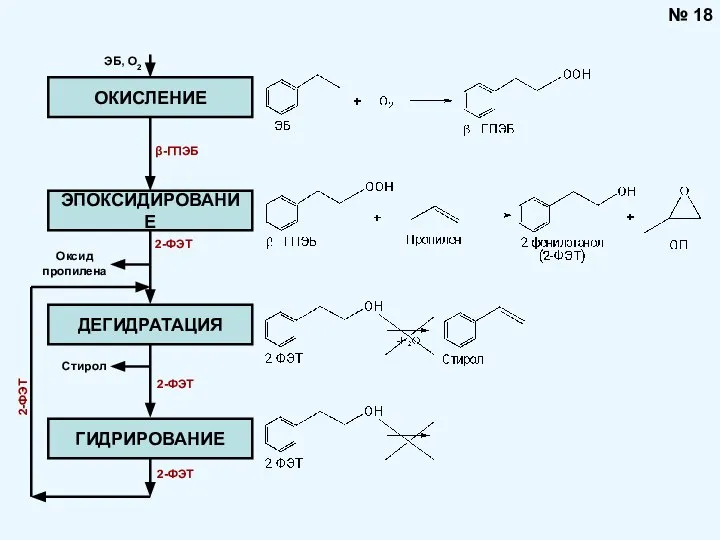
- 18. № 18 ОКИСЛЕНИЕ ЭПОКСИДИРОВАНИЕ ДЕГИДРАТАЦИЯ ГИДРИРОВАНИЕ ЭБ, О2 2-ФЭТ Оксид пропилена Стирол β-ГПЭБ 2-ФЭТ 2-ФЭТ 2-ФЭТ
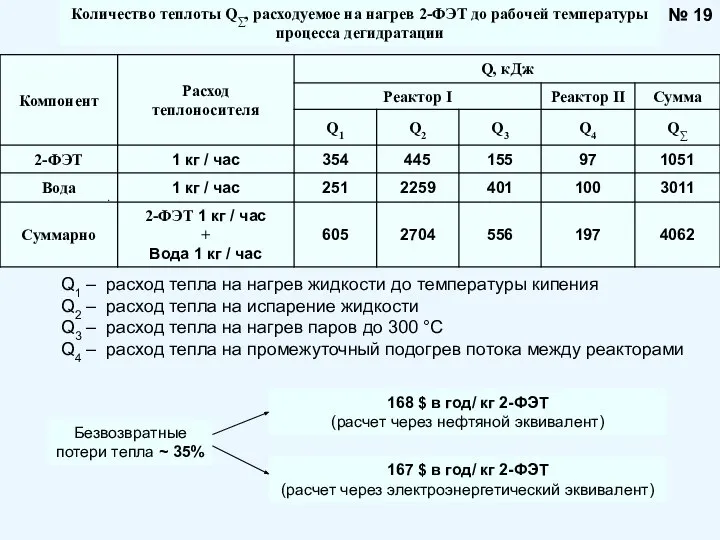
- 19. № 19 Количество теплоты Q∑, расходуемое на нагрев 2-ФЭТ до рабочей температуры процесса дегидратации Q1 –
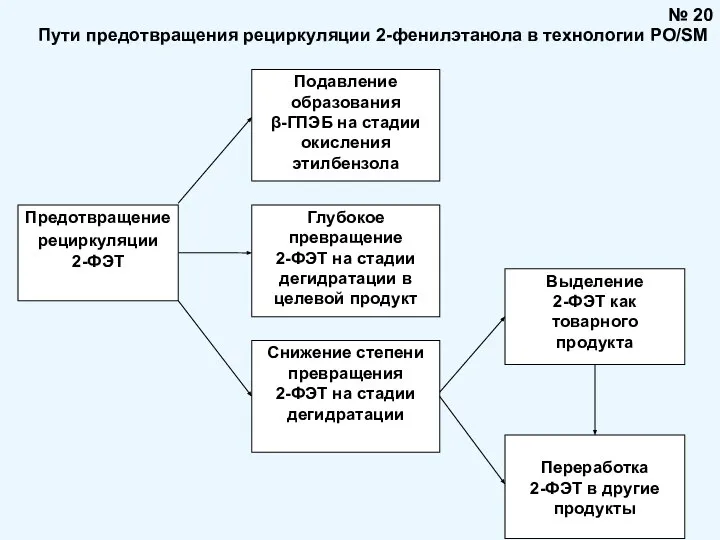
- 20. Пути предотвращения рециркуляции 2-фенилэтанола в технологии PO/SM № 20
- 21. Задаем состав исходной смеси как «а моль ЭБ и b моль кислорода». Реакция окисления ЭБ протекает
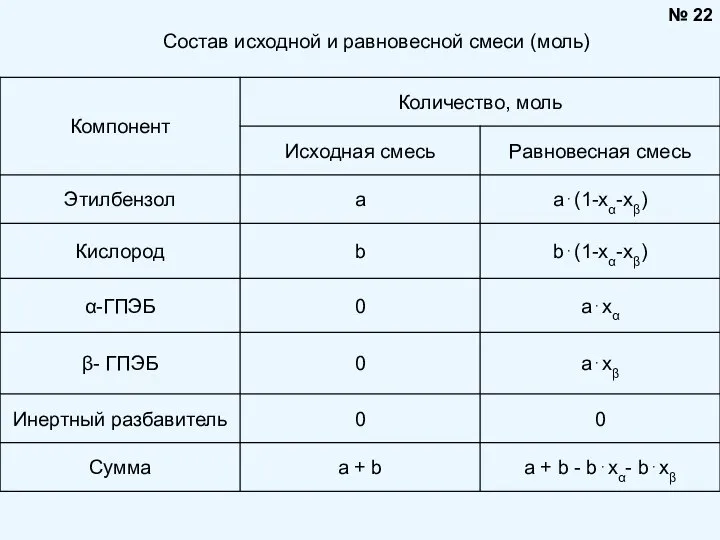
- 22. Состав исходной и равновесной смеси (моль) № 22
- 23. № 23 Для реакции в идеальной газовой смеси константа равновесия может быть выражена через парциальные давления
- 24. Парциальные давления продуктов и реагентов при достижении равновесия в неявном виде: № 24
- 25. Константа равновесия для реакции (1) Константа равновесия для реакции (2) , № 25
- 26. Далее, задаваясь составом исходной смеси (конкретные значения переменных a и b), давлением (конкретное значение переменной Pобщ)
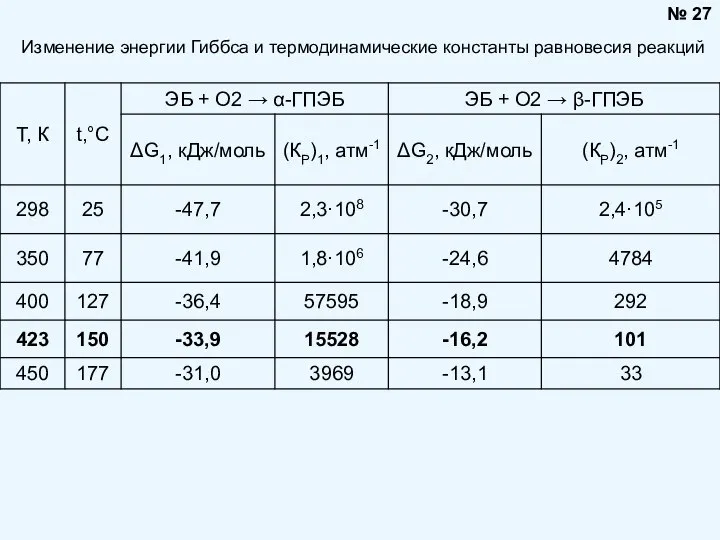
- 27. Изменение энергии Гиббса и термодинамические константы равновесия реакций № 27
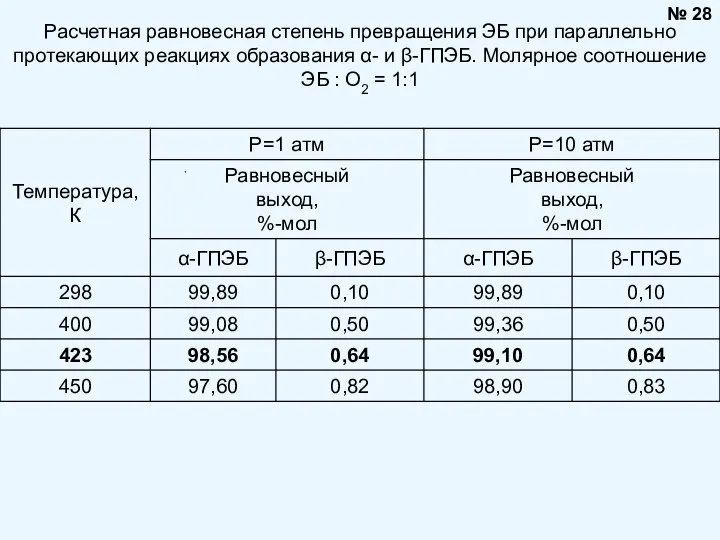
- 28. Расчетная равновесная степень превращения ЭБ при параллельно протекающих реакциях образования α- и β-ГПЭБ. Молярное соотношение ЭБ
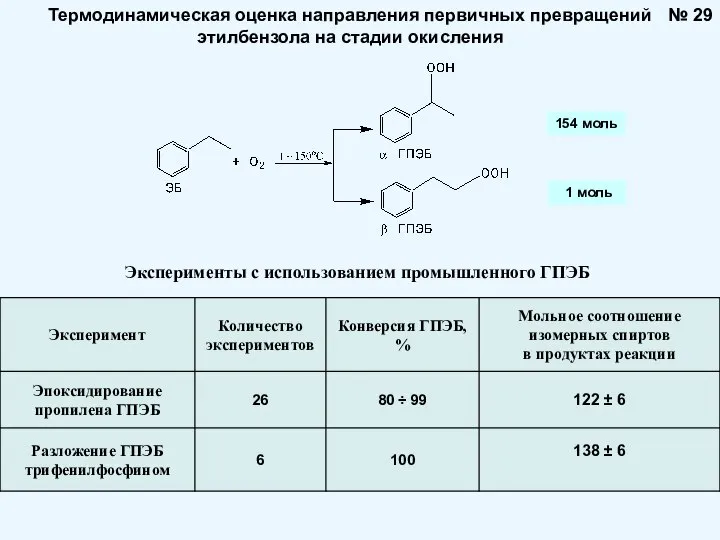
- 29. № 29 Термодинамическая оценка направления первичных превращений этилбензола на стадии окисления 154 моль 1 моль Эксперименты
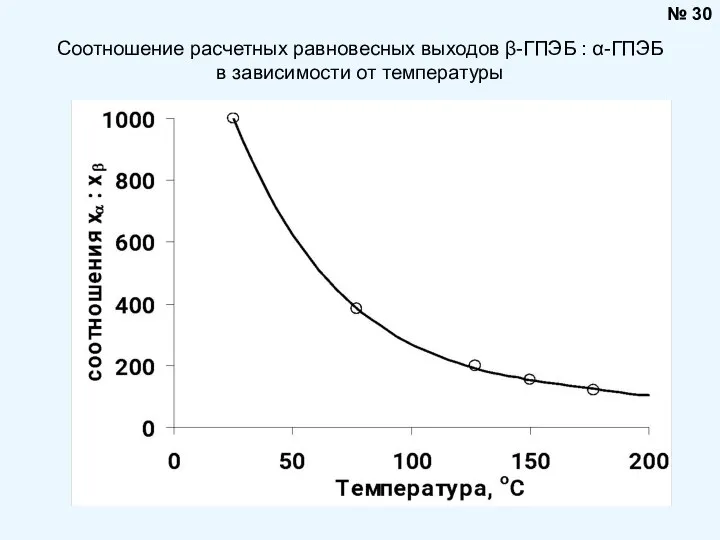
- 30. № 30 Соотношение расчетных равновесных выходов β-ГПЭБ : α-ГПЭБ в зависимости от температуры
- 31. Производство биотоплива с использованием зерновых, сахарного тростника и масличных в качестве сырья: в 2009 году Около
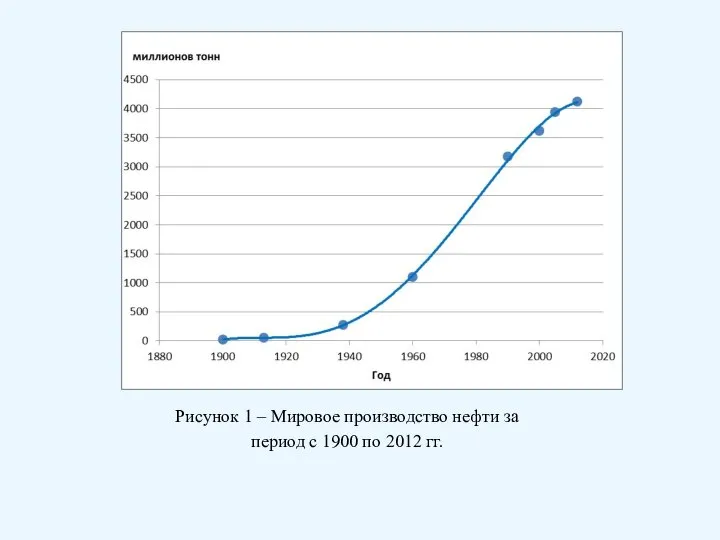
- 32. Рисунок 1 – Мировое производство нефти за период с 1900 по 2012 гг.
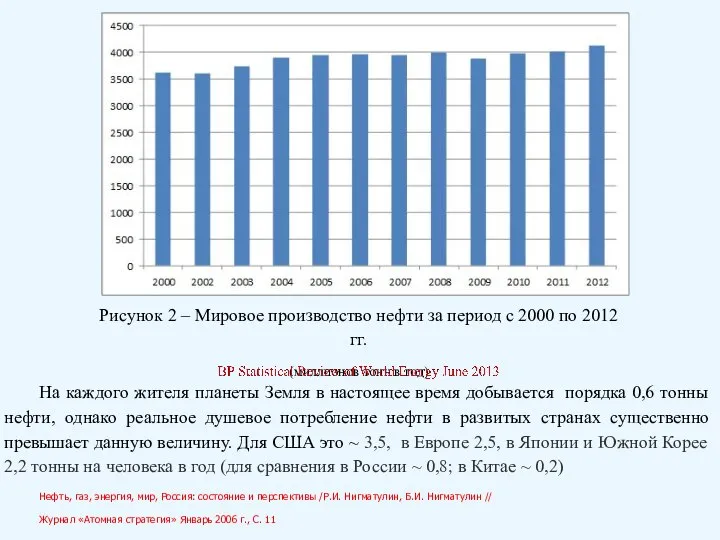
- 33. Рисунок 2 – Мировое производство нефти за период с 2000 по 2012 гг. (миллионов тонн в
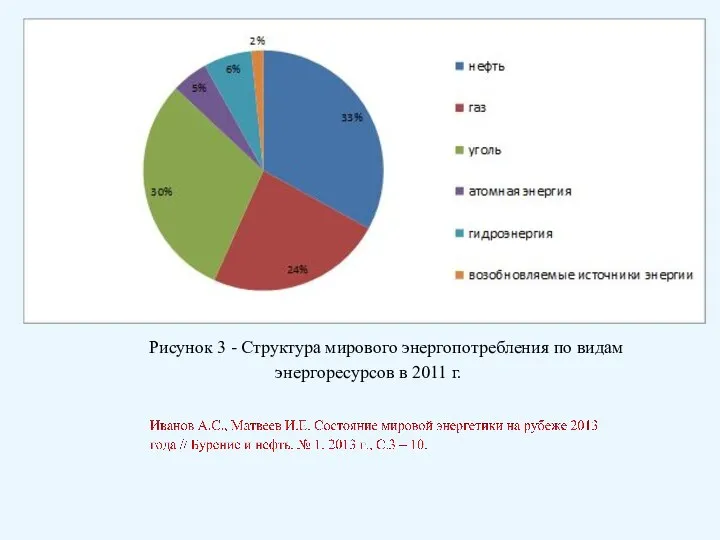
- 34. Рисунок 3 - Структура мирового энергопотребления по видам энергоресурсов в 2011 г.
- 40. Скачать презентацию














 Презентация по Химии "Кислоты" - скачать смотреть
Презентация по Химии "Кислоты" - скачать смотреть  Метод кислотноосновного титрования (Метод нейтрализации)
Метод кислотноосновного титрования (Метод нейтрализации) Кислотно-основное титрование
Кислотно-основное титрование Алюминий и его соединения
Алюминий и его соединения Коррозия металлов
Коррозия металлов Гормоны, биологически активные вещества органической природы
Гормоны, биологически активные вещества органической природы Гігієна води. Лекція 6
Гігієна води. Лекція 6 Задачи на определение массовой доли веществ в смесях
Задачи на определение массовой доли веществ в смесях Счастливы вместе с химией
Счастливы вместе с химией Строение атома
Строение атома Кобаламины(витамин В12) антианемический
Кобаламины(витамин В12) антианемический Простые вещества – металлы и неметаллы
Простые вещества – металлы и неметаллы Комплексные соединения
Комплексные соединения Процессы и аппараты химической технологии
Процессы и аппараты химической технологии Синтез 2,4-диметил-3,5-ди (этоксикар-бонил) пиррол
Синтез 2,4-диметил-3,5-ди (этоксикар-бонил) пиррол Презентация по Химии "Краткая история развития химических знаний" - скачать смотреть
Презентация по Химии "Краткая история развития химических знаний" - скачать смотреть  Составление уравнений ОВР
Составление уравнений ОВР Свойства растворов. Протолитическая теория кислот и оснований Бренстеда-Лоури
Свойства растворов. Протолитическая теория кислот и оснований Бренстеда-Лоури Азот и его соединения
Азот и его соединения Спирты: классификация, изомерия, номенклатура
Спирты: классификация, изомерия, номенклатура АЛКЕНЫ – НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ.
АЛКЕНЫ – НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ. Физико-химические методы исследования и техника лабораторных работ
Физико-химические методы исследования и техника лабораторных работ Нанотехнологии в химии
Нанотехнологии в химии  Арбузный снег. Предположения
Арбузный снег. Предположения Моторные масла. Свойства, состав, классификация
Моторные масла. Свойства, состав, классификация Основы строения органических соединений
Основы строения органических соединений Геохимические показатели техногенеза
Геохимические показатели техногенеза Обмен веществ и энергии в клетке
Обмен веществ и энергии в клетке