В качестве исходных веществ для установления титра растворов кислот используют тетраборат
натрия или карбонат натрия безводный, а для установления титра растворов щелочей - щавелевую Н2С2O4 · 2H2O или янтарную Н2С2H4O4кислоту. Все эти вещества весьма удобны для работы и дают хорошие результаты при титровании.
Для выяснения сущности процессов, происходящих при кислотно-основном титровании, изучим реакцию среды в эквивалентной точке при различных случаях титрования. При данном методе точка эквивалентности может лежать в нейтральной (рН = 7), щелочной (рН > 7) и кислой среде (рН < 7).





 Особенности строения ионных кристаллов. Постоянная Моделунга. Энергия кристаллической решётки. Цикл Борна-Габера
Особенности строения ионных кристаллов. Постоянная Моделунга. Энергия кристаллической решётки. Цикл Борна-Габера Атомдар мен молекулалар
Атомдар мен молекулалар Липиды
Липиды Нуклеопротеины
Нуклеопротеины Кислотно-основное титрование. Аналитическая химия
Кислотно-основное титрование. Аналитическая химия Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Презентація по хімії на тему:БУДІВЕЛЬНІ МАТЕРІАЛИ
Презентація по хімії на тему:БУДІВЕЛЬНІ МАТЕРІАЛИ  Метаморфогенные месторождения
Метаморфогенные месторождения Химия в медицине
Химия в медицине Увеличение эффективности печи установки АТ
Увеличение эффективности печи установки АТ Низкомолекулярные органические соединения витамины
Низкомолекулярные органические соединения витамины Амфотерні оксиди та гідроксиди
Амфотерні оксиди та гідроксиди Кислотно-основное титрование в неводных средах
Кислотно-основное титрование в неводных средах Пентозофосфатный путь окисления глюкозы. Глюконеогенез. (Лекция 5)
Пентозофосфатный путь окисления глюкозы. Глюконеогенез. (Лекция 5) Материаловедение. Влияние нагрева на структуру деформированного металла. (Тема 5)
Материаловедение. Влияние нагрева на структуру деформированного металла. (Тема 5) Скорость реакции и температура. (Лекция 10)
Скорость реакции и температура. (Лекция 10) Презентация Палладий
Презентация Палладий  Стеклопластики. Типы стеклопластиков и их классификация
Стеклопластики. Типы стеклопластиков и их классификация 热塑性复合材料的分类及特性
热塑性复合材料的分类及特性 Растворы неэлектролитов. Закон Вант- Гоффа и Рауля. Растворы электролитов. Теория электронной диссоциации
Растворы неэлектролитов. Закон Вант- Гоффа и Рауля. Растворы электролитов. Теория электронной диссоциации Влияние соли
Влияние соли Коррозия металлов
Коррозия металлов Мінерали та гірські породи
Мінерали та гірські породи Работу выполнила: Максименко Анна ученица 9 класса А ГОУ СОШ № 546 г. Москвы Руководитель: учитель химии Симонова Т.В.
Работу выполнила: Максименко Анна ученица 9 класса А ГОУ СОШ № 546 г. Москвы Руководитель: учитель химии Симонова Т.В. Презентация по химии МИНЕРАЛЬНЫЕ ВЕЩЕСТВА
Презентация по химии МИНЕРАЛЬНЫЕ ВЕЩЕСТВА  Витамин В2 (рибофлавин)
Витамин В2 (рибофлавин)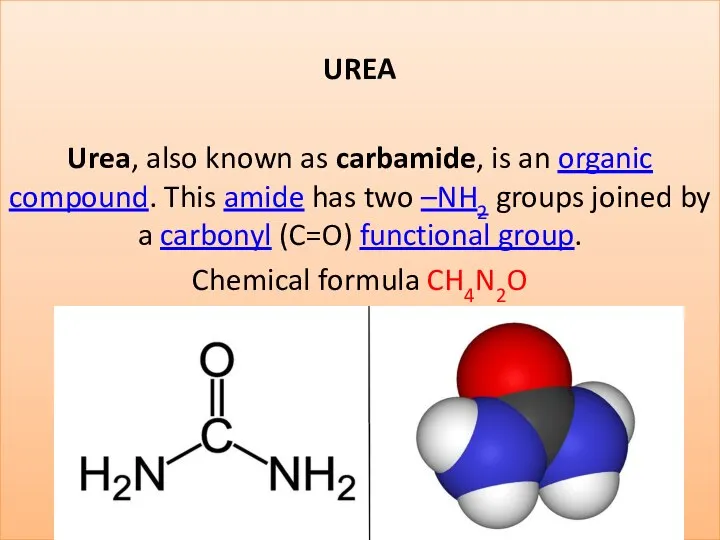 Urea (carbamide)
Urea (carbamide) Рекомендации по подготовке учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии
Рекомендации по подготовке учащихся к выполнению заданий различного уровня сложности ЕГЭ по химии