Содержание
- 2. 1. Определение и классификация 2. Отдельные представители 3. Обнаружение кислот 4.Техника безопасности 5. Типичные реакции кислот
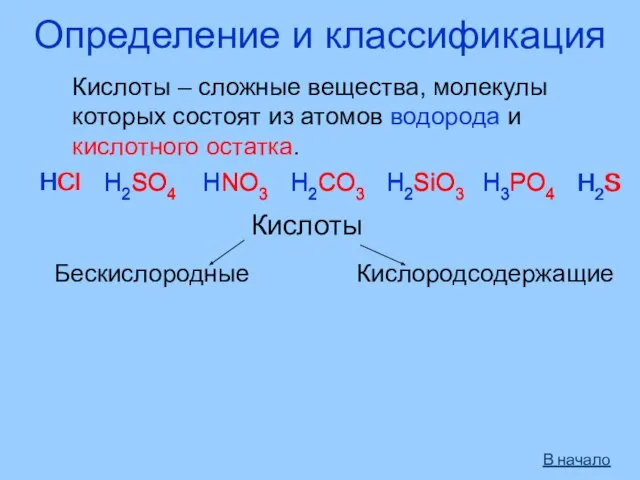
- 3. Определение и классификация Кислоты – сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка.
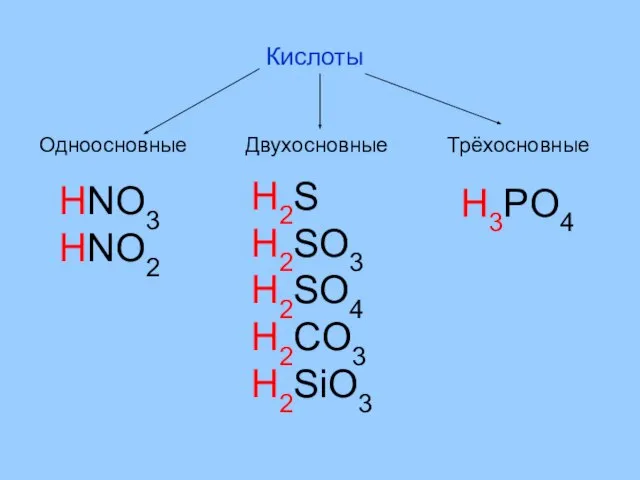
- 4. Кислоты Одноосновные Двухосновные Трёхосновные HNO3 HNO2 H2S H2SO3 H2SO4 H2CO3 H2SiO3 H3PO4
- 5. Органические кислоты, встречаемые вами в повседневной жизни Щавелевая Лимонная Уксусная Молочная Аскорбиновая В начало
- 6. Серная кислота – бесцветная жидкость, вязкая, как масло, не имеющая запаха, почти вдвое тяжелее воды. Серная
- 7. Угольная кислота H2CO3 УГОЛЬНАЯ КИСЛОТА - очень слабая и непрочная кислота. Образуется при растворении диоксида углерода
- 8. СОЛЯНАЯ КИСЛОТА - бесцветная, «дымящая» на воздухе жидкость. Составная часть желудочного сока. Соляная кислота НCl В
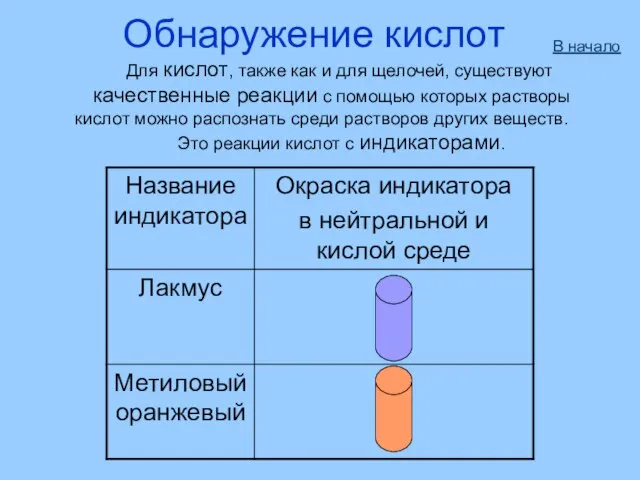
- 9. Обнаружение кислот Для кислот, также как и для щелочей, существуют качественные реакции с помощью которых растворы
- 10. Техника безопасности При растворении серной кислоты нужно вливать её тонкой струёй в воду при помешивании В
- 11. Типичные реакции кислот 1. Кислота + основание → соль + вода Н Сl + Na OH
- 12. В начало
- 13. Каким правилом техники безопасности пренебрёг лаборант? В начало
- 15. Скачать презентацию









 Обмен нуклеотидов
Обмен нуклеотидов Введение в биохимию. Атлас новых профессий
Введение в биохимию. Атлас новых профессий Химия - важный элемент жизни Работу выполнили: ученики 10 класса МКОУ Советской СОШ
Химия - важный элемент жизни Работу выполнили: ученики 10 класса МКОУ Советской СОШ Свойства воды
Свойства воды Алкадиены. Строение, изомерия, номенклатура, физические и химические свойства
Алкадиены. Строение, изомерия, номенклатура, физические и химические свойства Липиды
Липиды Оксиди Неметалічних Елементів Підготував : Учень 10 Класу Кійко Едуард
Оксиди Неметалічних Елементів Підготував : Учень 10 Класу Кійко Едуард  Выращивание кристаллов Выполнила: ученица 9 «А» класса МОУ «СОШ №1» Решетникова Анна
Выращивание кристаллов Выполнила: ученица 9 «А» класса МОУ «СОШ №1» Решетникова Анна Аффинаж солей урана. Получение оксидов урана
Аффинаж солей урана. Получение оксидов урана Тротуарная плитка, генерирующая электричество
Тротуарная плитка, генерирующая электричество Фосфорная кислота
Фосфорная кислота Классификация неорганических веществ
Классификация неорганических веществ Основы химической кинетики
Основы химической кинетики Презентация по Химии "Спирти. Хімічні та фізичні властивості спиртів." - скачать смотреть бесплатно
Презентация по Химии "Спирти. Хімічні та фізичні властивості спиртів." - скачать смотреть бесплатно Аттестационная работа. Методическая разработка исследователького урока Строение вещества. Молекулы и атомы
Аттестационная работа. Методическая разработка исследователького урока Строение вещества. Молекулы и атомы Глюкоза. Будова глюкози. Хімічні властивості глюкози
Глюкоза. Будова глюкози. Хімічні властивості глюкози Методы исследования белковых молекул
Методы исследования белковых молекул Олигосахариды. 10 класс
Олигосахариды. 10 класс Ионообменная хроматография и ее применение
Ионообменная хроматография и ее применение Резиновое яйцо. Влияние кислоты (на примере уксусной) на кости и зубы человека
Резиновое яйцо. Влияние кислоты (на примере уксусной) на кости и зубы человека Характеристика шкідливих хімічних речовин, забруднювачів атмосфери
Характеристика шкідливих хімічних речовин, забруднювачів атмосфери Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Кислоты и соли. (8 класс)
Кислоты и соли. (8 класс) Значение химии в жизни человека
Значение химии в жизни человека Водородная, ионная, донорно-акцепторная химические связи
Водородная, ионная, донорно-акцепторная химические связи Р-элементы III группы
Р-элементы III группы Органическая химия. Пособие
Органическая химия. Пособие Функціональні матеріали для високоенергетичної електроніки. (Лекція 1)
Функціональні матеріали для високоенергетичної електроніки. (Лекція 1)