Содержание
- 2. ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ Химическая кинетика - раздел химии, изучающий скорости и механизмы химических процессов, а
- 3. классификация реакций по числу частиц, участвующих в элементарном акте реакции (молекулярность) по числу фаз, участвующих в
- 4. молекулярность Молекулярность реакции – это минимальное число молекул, участвующих в элементарном химическом процессе. Мономолекулярные реакции: C2H6
- 5. гомогенные и гетерогенные реакции Гомогенные реакции – это реакции, протекающие в однородной среде ( в одной
- 6. каталитические и автокаталитические реакции Каталитические реакции – это реакции, протекающие под действием катализаторов. А + В
- 7. простые и сложные реакции Простые реакции - это реакции, протекающие в одну стадию, в них участвуют
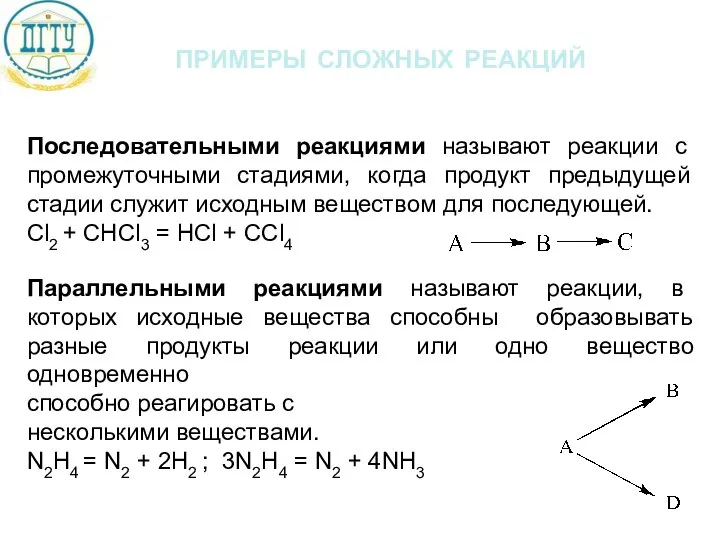
- 8. примеры сложных реакций Последовательными реакциями называют реакции с промежуточными стадиями, когда продукт предыдущей стадии служит исходным
- 9. обратимые и необратимые реакции Обратимые реакции - это реакции, которые при одних и тех же условиях
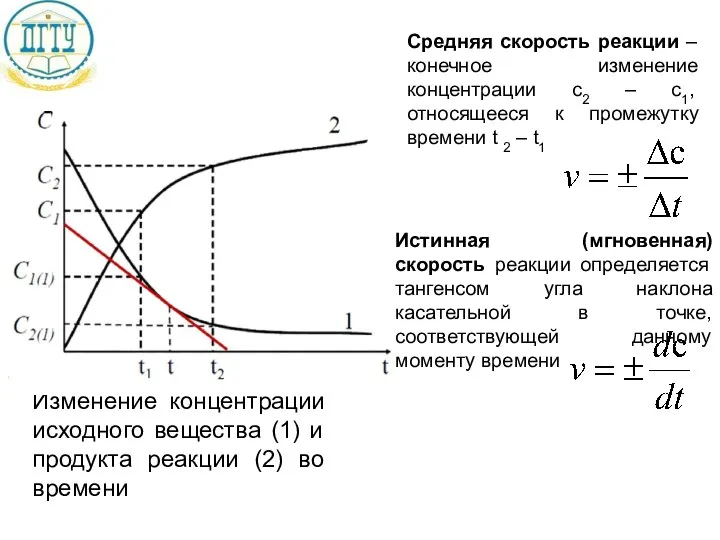
- 10. скорость химической реакции Под скоростью гомогенной химической реакции (ν) понимают изменение количества вещества (∆n) за единицу
- 11. Средняя скорость реакции – конечное изменение концентрации c2 – c1, относящееся к промежутку времени t 2
- 12. факторы, влияющие на скорость реакции природа реагирующих веществ концентрация реагирующих веществ физическое состояние веществ температура катализатор
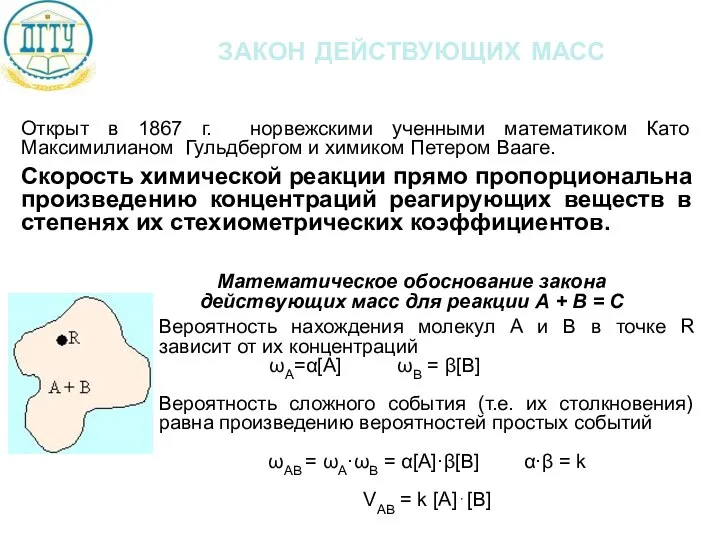
- 13. закон действующих масс Открыт в 1867 г. норвежскими ученными математиком Като Максимилианом Гульдбергом и химиком Петером
- 14. кинетические уравнения Кинетическое уравнение – это математическое выражение, связывающие скорость реакции с концентрацией реагирующих веществ. Для
- 15. константа скорости реакции k – коэффициент пропорциональности, называемый константой скорости реакции физический смысл Константа скорости реакции
- 16. правило вант-гоффа Якоб Хендрик Вант-Гофф При повышении температуры на 100 скорость химической реакции увеличивается в 2-4
- 17. теория активных столкновений Теория активных столкновений позволяет вывести математическое соотношение между скоростью реакции, частотой столкновений и
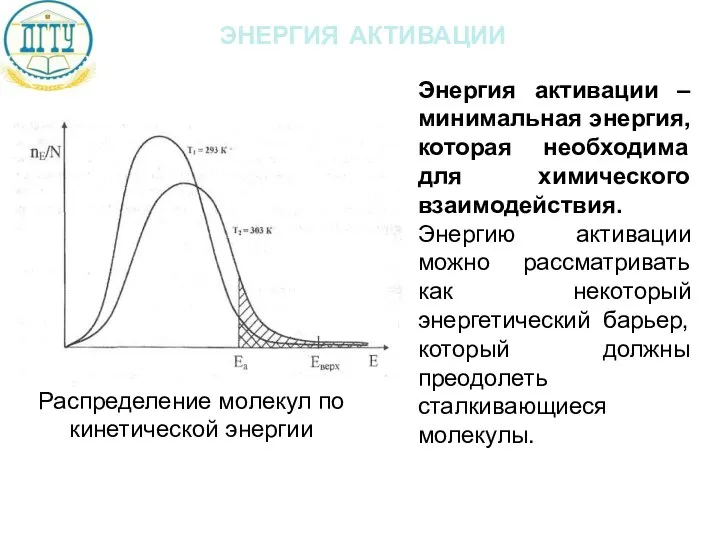
- 18. энергия активации Распределение молекул по кинетической энергии Энергия активации –минимальная энергия, которая необходима для химического взаимодействия.
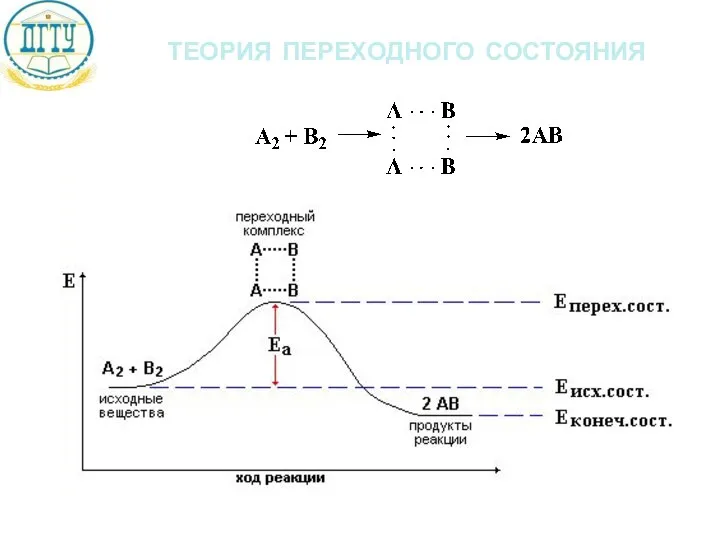
- 19. теория переходного состояния
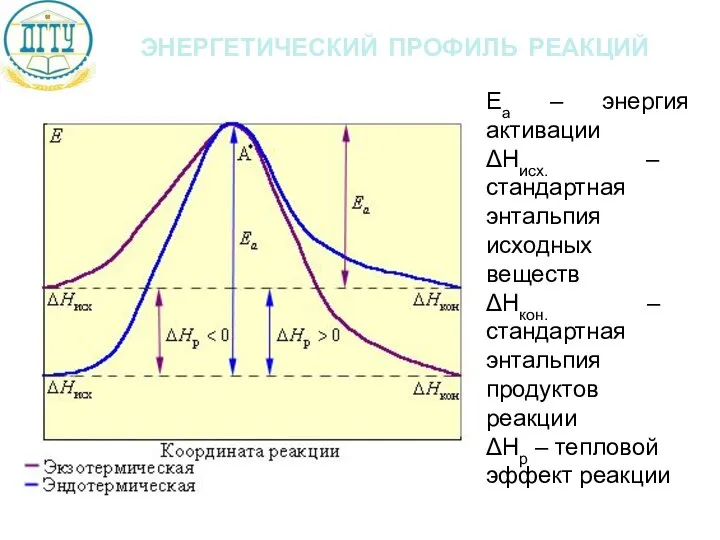
- 20. энергетический профиль реакций Еа – энергия активации ΔНисх. – стандартная энтальпия исходных веществ ΔНкон. – стандартная
- 21. катализатор Вещества, не расходующиеся в результате протекания реакции, но влияющие на ее скорость называются катализаторами. Явление
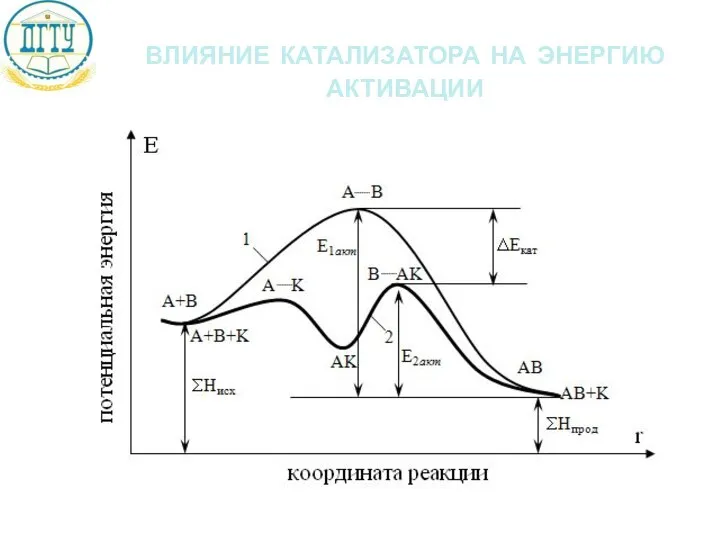
- 22. влияние катализатора на энергию активации
- 23. типы катализаторов При гомогенном катализе - катализатор и реагирующие вещества находятся в одной фазе I- схема
- 24. химическое равновесие Состояние обратимой реакции, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим
- 25. константа химического равновесия Константа химического равновесия - это отношение произведения равновесных концентраций продуктов реакции к произведению
- 26. принцип ле шателье Химическое равновесие является подвижным. При изменении внешних условий скорости прямой и обратной реакций
- 28. Скачать презентацию


















 Физико-химические свойства газов
Физико-химические свойства газов Пены. Пенообразование
Пены. Пенообразование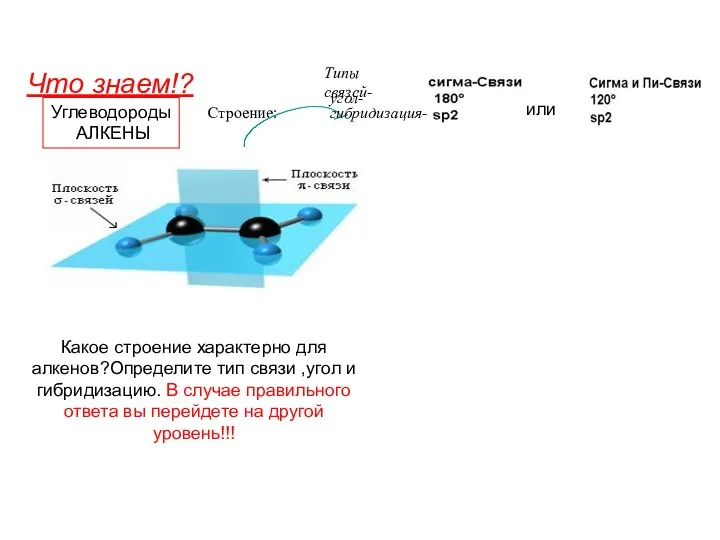 Углеводороды. Алкены
Углеводороды. Алкены Тема: Неметаллы
Тема: Неметаллы Презентация по Химии "Периодическая система химических элементов" - скачать смотреть
Презентация по Химии "Периодическая система химических элементов" - скачать смотреть  Химические реакции. Закон сохранения массы веществ
Химические реакции. Закон сохранения массы веществ «Чорне золото» Виконала роботу Учениця 11-а класу Макарівського НВК Заріцька Вікторія
«Чорне золото» Виконала роботу Учениця 11-а класу Макарівського НВК Заріцька Вікторія  Внеурочная работа по химии. Краеведение
Внеурочная работа по химии. Краеведение Свойства растворов ВМС
Свойства растворов ВМС Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда
Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда Химическая промышленность. Создание пигментов
Химическая промышленность. Создание пигментов Жаңа дәрілерді жасау
Жаңа дәрілерді жасау Правила ориентации в монозамещённых и дизамещённых ароматических углеводородах
Правила ориентации в монозамещённых и дизамещённых ароматических углеводородах Автор- Салтанова Наталья Викторовна ГБОУ СОШ № 599
Автор- Салтанова Наталья Викторовна ГБОУ СОШ № 599 Производство самодельного мыла: технология, экономика
Производство самодельного мыла: технология, экономика Алкины. 10 класс
Алкины. 10 класс Сними с полки банку с горючей жидкостью
Сними с полки банку с горючей жидкостью Поверхностно-активные полимеры. Лекция 10
Поверхностно-активные полимеры. Лекция 10 Оксиды азота.
Оксиды азота. Акцепторы катионов. Криптанды. Cферанды
Акцепторы катионов. Криптанды. Cферанды Самородные элементы. Сера, ртуть
Самородные элементы. Сера, ртуть Аргентум, или серебро
Аргентум, или серебро Лекция 4. Химическая термодинамика
Лекция 4. Химическая термодинамика “TERRA” программасы бойынша ферросиликоалюминийдің балқуының фазалық күйіндегі термодинамикалық есептеуі
“TERRA” программасы бойынша ферросиликоалюминийдің балқуының фазалық күйіндегі термодинамикалық есептеуі Інсектициди для захисту сливи та персеку
Інсектициди для захисту сливи та персеку Физические и химические свойства воды
Физические и химические свойства воды Чистые вещества и смеси. Методы разделения и очистки веществ
Чистые вещества и смеси. Методы разделения и очистки веществ Системный анализ и моделирование процессов. Горение паро-газо-воздушного облака
Системный анализ и моделирование процессов. Горение паро-газо-воздушного облака