Содержание
- 2. ПЕРЕЧЕНЬ ПРАКТИЧЕСКИХ НАВЫКОВ ПО ОБЩЕЙ ХИМИИ ДЛЯ ЭКЗАМЕНА Расчеты по теме: «Способы выражения концентрации растворов». Расчеты
- 3. Примеры заданий: 1. Рассчитайте, сколько граммов сульфата натрия следует взять для приготовления 250 мл 0,2 н
- 4. 2. В 500 мл раствора содержится 8,2 г натрий фосфата. Определите молярную концентрацию эквивалента и массовую
- 5. 3. Определите, какова молярная и моляльная концентрации 20%-ного раствора серной кислоты (ρ = 1,3 г/мл).
- 6. 4. Вычислите рН буферного раствора, полученного смешением 50 мл раствора СН3СООН и 100 мл раствора СН3СООNa
- 7. 5. Вычислите рН буферного раствора, полученного смешением 8 мл раствора NH3·Н2О и 4 мл раствора NH4Cl
- 8. 6. На реакцию с 10 мл раствора FeSO4 в кислой среде израсходовано 20 мл 0,2н раствора
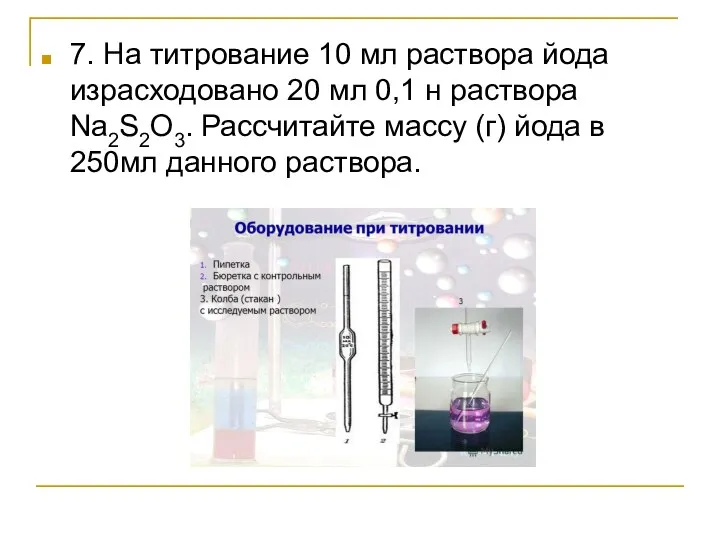
- 9. 7. На титрование 10 мл раствора йода израсходовано 20 мл 0,1 н раствора Na2S2O3. Рассчитайте массу
- 10. 8. Подобрать реактивы и провести реакцию получения комплексного соединения – аммиаката меди. Составить уравнение реакции получения
- 11. 9. Получить золь: отмерить 10 мл 0,005 М раствора K4[Fe(CN)6] и прибавить 3 мл 0,005 М
- 12. 10. Получить золь берлинской лазури: отмерить 5 мл 0,005 М раствора K4[Fe(CN)6] и прибавить 2 мл
- 14. Скачать презентацию








![9. Получить золь: отмерить 10 мл 0,005 М раствора K4[Fe(CN)6] и](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/757959/slide-10.jpg)

 Волокно капрон
Волокно капрон Полимеры, пластмассы и изделия из них
Полимеры, пластмассы и изделия из них Моделирование, как метод научного исследования. Ограниченный метод Хартри-Фока
Моделирование, как метод научного исследования. Ограниченный метод Хартри-Фока Электролиз: опыты к заданиям ЕГЭ
Электролиз: опыты к заданиям ЕГЭ Битумы и материалы на основе битумов
Битумы и материалы на основе битумов Камни мира. Минералы
Камни мира. Минералы Молярный объём газов
Молярный объём газов Катаболизм фенилаланина, тирозина
Катаболизм фенилаланина, тирозина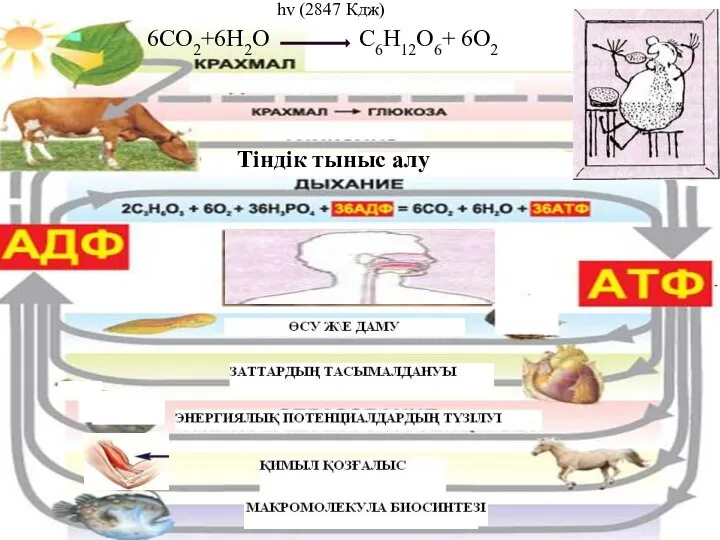 Биологиялық тотығу электрондардың тасымалдану тізбегі тотығудан фосфорлану
Биологиялық тотығу электрондардың тасымалдану тізбегі тотығудан фосфорлану Установка гидрокрекинга в составе завода глубокой переработки нефти ООО Кинеф
Установка гидрокрекинга в составе завода глубокой переработки нефти ООО Кинеф Зависимость свойств химических элементов от положения в ПСХЭ
Зависимость свойств химических элементов от положения в ПСХЭ Презентация по Химии "Химическая природа белка" - скачать смотреть
Презентация по Химии "Химическая природа белка" - скачать смотреть  АТФ (Аденозинтрифосфат)
АТФ (Аденозинтрифосфат) Азот. Физические и химические свойства азота
Азот. Физические и химические свойства азота Классификация и краткие характеристики основных групп токсикантов
Классификация и краткие характеристики основных групп токсикантов Хлороводород. Соляная кислота.
Хлороводород. Соляная кислота.  Уксусная кислота
Уксусная кислота Основания. Физические свойства оснований
Основания. Физические свойства оснований Плавиковая кислота или фтористоводородная кислота
Плавиковая кислота или фтористоводородная кислота Едкость Coca-Cola
Едкость Coca-Cola Химический элемент платина
Химический элемент платина Липидтер
Липидтер Подготовил учитель химии МОУ СОШ № 16 С. Александровского Александровского района Кононенко Светлана Юрьевна
Подготовил учитель химии МОУ СОШ № 16 С. Александровского Александровского района Кононенко Светлана Юрьевна Исследование содержания аскорбиновой кислоты в зимних сортах яблок, районированных в Петровском районе Ставропольского края
Исследование содержания аскорбиновой кислоты в зимних сортах яблок, районированных в Петровском районе Ставропольского края  Гравиметрические методы анализа
Гравиметрические методы анализа Дәрілік препараттардың синтезі мен олардың классификациясы
Дәрілік препараттардың синтезі мен олардың классификациясы Необратимый (совместный) гидролиз
Необратимый (совместный) гидролиз Хроматофокусирование: новые подходы в концентрировании и разделении
Хроматофокусирование: новые подходы в концентрировании и разделении